| 赵明芳, 中国医科大学附属第一医院肿瘤内科博士, 教授、主任医师, 硕士研究生导师。1995年毕业于中国医科大学。主要从事实体肿瘤的诊断与治疗以及肿瘤的生物免疫治疗, 同时掌握超声诊断及超声或CT引导下实体肿瘤的微创治疗等新技术,现任中国胸部肿瘤治疗协作组(CTONG)成员, 中国抗癌协会CSCO青年专家委员会委员, 中国抗癌协会肺癌专业委员会内科学组委员, 国际肺癌研究协会(IASLC)会员, 中国抗癌协会老年肿瘤专业委员会执行委员, 中华医学会辽宁分会内科学会秘书及委员, 辽宁省抗癌协会肺癌专业委员会常委, 辽宁省抗癌协会肿瘤标志物委员会常委, 辽宁省细胞生物学会常务理事, 辽宁省抗癌协会化疗专业委员会委员等,主持卫生部课题2项, 吴阶平基金会课题1项, 辽宁省科技厅课题2项, 辽宁省教育厅青年基金课题1项, 参与国家自然基金课题7项,发表学术论文近20篇,参编教材1部。 |
Wu YL, Zhou CC, Hu CP, et al. Afatinib versus Cisplatin plus Gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): An open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(2):213-222.
1b。
表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)与化疗相比, 能够明显延长EGFR突变晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的生存期, 目前已开展许多相关临床试验, 其中LUX-Lung 3是比较培美曲塞顺铂化疗与阿法替尼(一种ErbB家族不可逆的TKI)靶向治疗的全球性试验, 作为亚洲部分国家一线标准化疗方案, 吉西他滨和顺铂(Gemcitabine + Platinol, GP)与阿法替尼的疗效有何差异尚不知。
对EGFR突变亚裔晚期NSCLC患者行GP方案化疗或阿法替尼靶向治疗, 比较两种治疗方法的无进展生存期(progression-free survival, PFS)及疾病控制率(disease control rate, DCR)。
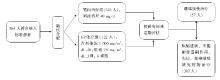
• 研究条件:LUX-Lung 6研究, 中国、泰国和韩国3个国家的36个临床中心参与。
• 研究起止时间:2010年4月27日至2012年10月29日。
• 研究方法:多中心, 非盲, Ⅲ 期, 随机对照试验。
• 研究对象:未接受治疗的Ⅲ B期(存在胸腔积液)或Ⅳ 期肺癌患者, ECOG PS评分为0/1分, 按照RECIST1.1标准存在可测量病灶, 器官功能良好, 肿瘤组织经中心实验室确认EGFR突变, 病理学确诊为腺癌。
• 干预措施:患者以2∶ 1比例随机分为阿法替尼靶向治疗组和GP化疗组, 具体实施方案见图1, 按研究方案定期评估, 其中阿法替尼组患者若无预期毒副反应, 剂量可增加至50 mg/d, 若患者出现3度及以上与治疗相关的不良事件, 2度腹泻超过48小时, 2度恶心或呕吐超过7天, 2度及以上肾功能损伤, 停止治疗至少14天, 直至严重程度降至1度或恢复正常水平。
• 评价指标:主要终点指标为PFS, 次要终点指标为DCR、总生存期(overall survival, OS)、疾病控制持续时间、安全性、阿法替尼药物动力学等。
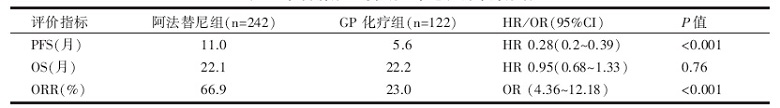
入组364名EGFR突变患者(阿法替尼组242人, GP化疗组122人), 其中352名患者至少接受一种研究药物治疗, PFS的随访时间是16.6个月, 结果显示, 阿法替尼靶向治疗组较GP化疗组能明显延长PFS(11.0个月vs. 5.6个月, P< 0.001); 此外, 所有入组患者与最常见的两种EGFR突变(19 Del和L858R突变)的患者PFS相同。两组的中位OS分别为22.1个月和22.2个月(P=0.76), 总OS数据暂不成熟。靶向治疗较化疗明显提高总有效率(overall response rate, ORR)(66.9% vs. 23.0%, P< 0.001), 见表1。靶向治疗(较化疗)还能明显改善健康状态和生活质量(62.7% vs. 32.7%, P< 0.001), 延长疾病控制时间(风险比0.56, P=0.000 2)。
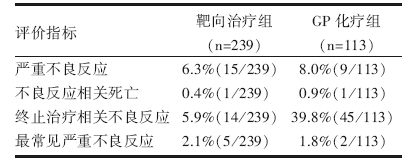
阿法替尼与化疗引起的最常见的毒副反应分别是腹泻、皮疹或粉刺、口腔炎或黏膜炎、呕吐、恶心、中性粒细胞减少及白细胞减少, 是终止治疗的重要原因; 靶向治疗与化疗引起的最常见治疗相关严重不良事件分别是皮疹或粉刺(1.3%)、腹泻(0.8%)和血小板减少(1.8%); 不良反应相关死亡均有1例, 见表2。
一线阿法替尼能明显提高EGFR突变阳性的亚裔晚期NSCLC患者的PFS, 阿法替尼或许能够成为这类患者一线治疗方案的合理选择。
| 表1 靶向治疗组与化疗组在总人群中的疗效HR: hazard ratio, 风险比; OR: odds ratio, 比值比; CI: confidence interval, 可信区间。 |
| 表2 靶向治疗组和化疗组的严重不良反应 |
阿法替尼是一种不可逆性ErbB家族TKI, 与第一代可逆性抑制ErbB受体信号转导的靶向药物不同, 能同时阻断表皮生长因子受体EGFR、HER2(ErbB2)、ErbB4信号通路。2013年, 一项全球多中心Ⅲ 期临床研究(LUX-Lung 3)证实阿法替尼一线治疗晚期EGFR突变NSCLC优于培美曲塞联合顺铂[1]。LUX-Lung 6研究是继LUX-Lung 3之后, 阿法替尼组对比吉西他滨联合顺铂(GP组)一线治疗EGFR突变阳性晚期NSCLC前瞻性、多中心、随机、开放性Ⅲ 期临床研究[2]。
LUX-Lung 6研究具有如下特点。第一, 该研究是目前入组EGFR突变患者数最大的一项临床研究, 入组患者达到364例, 并预设19 Del和21 L858R亚组。第二, 与LUX-Lung 3研究不同, LUX-Lung 6纳入的患者全部来自中国、泰国、韩国的36个中心。因此更能反应阿法替尼对亚洲晚期NSCLC的治疗情况。第三, 该研究采用同一个中心实验室进行TheraScreen EGFR基因检测, 减少了EGFR检测结果的偏差。同时两组患者基线特征分布比较均衡:阿法替尼组和GP组分别为女性(64% vs. 68%)、非吸烟者(74.8% vs. 81.1%)、19 Del(51.2% vs. 50.8%)、L858R(38% vs. 37.7%)等。基线状态的均衡为数据结果的准确解读提供了保障。第四, 该研究采用独立中心评估, 避免了研究者的主观偏倚。Lux-Lung 6的研究结果显示, 主要终点指标PFS, 阿法替尼组比GP组明显延长(中位PFS 11 个月 vs. 5.6个月, HR 0.28, P< 0.000 1)。两组OS分析时数据还不成熟, 阿法替尼组和GP组分别是22.1个月和22.2个月, 差异没有统计学意义。阿法替尼组的ORR(66.9% vs. 23%, P< 0.000 1)、DCR(92.6% vs. 76.2%, P< 0.000 1)均高于GP组。亚组分析的结果显示, 19 Del与21 L858R患者疾病进展的风险比分别为0.20 和0.32。该研究奠定了阿法替尼在EGFR突变阳性NSCLC的治疗地位, 使阿法替尼成为继吉非替尼、厄洛替尼和我国的埃可替尼之后, EGFR突变阳性的晚期NSCLC一线治疗的又一选择。
当然LUX-Lung 6 研究也有一定局限性。首先, 该研究仅对比了二代TKI阿法替尼与化疗之间的疗效, 没有比较两代TKI之间的差异。正在进行的LUX-Lung 7研究将比较阿法替尼和吉非替尼在EGFR突变阳性NSCLC的疗效差异, 期待这一结果能给我们一个答案。其次, 该研究一线TKI或化疗后两组患者后续治疗没有强制性交叉, 而总人群OS没有差异, 仍未回答EGFR突变阳性晚期NSCLC一线TKI和化疗孰优孰劣的问题。值得关注的是, 2014年ASCO上公布了LUX-Lung 6和LUX-Lung 3汇总分析后的数据显示[3], 对伴有19 Del突变的晚期NSCLC亚组人群, 阿法替尼对比化疗能带来超过12个月的OS获益(LUX-Lung 3 33.3个月vs. 21.1个月, LUX-Lung 6 31.4个月 vs. 18.4个月)。合并数据分析显示, 19 Del NSCLC阿法替尼对比化疗的OS为31.7个月 vs. 20.7个月(P=0.000 1), 而在伴有L858R突变的患者中阿法替尼对比化疗的OS为22.1个月 vs. 26.9个月(P=0.16)。这是否提示我们, 阿法替尼在19 Del突变患者应该一线选择, 而21 L858R突变患者应该在二线选择更合理呢?这个提示是否也适合于一代TKI药物呢?这个结果进一步引发了专家及学者对确定EGFR突变类型的临床意义以及一代EGFR-TKI与二代TKI阿法替尼治疗疗效差异的广泛讨论。
2014年张力教授团队进行了荟萃分析[4], 纳入荟萃分析的均为19 Del或21 L858R突变且接受EGFR-TKI进行一线治疗的患者, 间接和直接荟萃分析结果均显示, 19 DelNSCLC较21 L858R突变患者的PFS时间显著延长(HR19/21=0.59, 95%CI 0.38~0.92; HR19/21=0.75, 95%CI 0.65~0.85), 提示19 Del突变患者一线接受TKI治疗的PFS明显好于L858R突变患者的PFS, 但是该荟萃分析并没有进行OS的分析。
2005年Mitsudomi教授的研究显示, 19 Del和L858R突变患者反应率(response rate, RR)有差异, 100% vs. 67%, P=0.010 8, 而OS没有差异[5]。2006年, Riely教授报道, 34名EGFR突变晚期NSCLC患者接受过吉非替尼或厄洛替尼治疗后, 23名19 Del突变患者OS明显长于11名 L858R突变患者的OS(34个月vs. 8个月, P=0.01), 吉非替尼和厄洛替尼间没有差异[6]。同年, Jackman教授回顾分析接受吉非替尼或厄洛替尼治疗的22名19 Del和10名L858R突变患者, 19 Del突变患者的RR、PFS、OS均优于L858R突变患者, 分别是73% vs. 50%, 24个月vs. 10个月, 38个月vs. 17个月(P=0.04)[7]。这些小样本的分析结果, 推动了针对晚期NSCLC的EGFR突变不同类型及其对吉非替尼和厄洛替尼治疗是否存在差异的深入研究。2014年ASCO报道的WJTOG3405最终数据亚组分析显示[8], 吉非替尼对19 Del和21 L858R突变患者的PFS 分别是9.1个月 和9.7 个月, OS 是35.5个月和32.2个月, PFS和OS均没有看到任何差异。同会报道的厄洛替尼联合贝伐单抗对比单药厄洛替尼治疗EGFR突变阳性晚期NSCLC研究的亚组分析结果显示, 无论联合治疗组还是单药治疗组, 19 Del组的PFS均优于21 L858R组, 但OS数据还不成熟[9]。
更为复杂的是, Lee等[10]用直接测序的方法分析了170例伴有EGFR突变的晚期NSCLC患者, 对于19 Del的患者又进行了突变位点的亚组分析发现, 伴有18个核苷酸缺失(n=10)(delL747_P753insS)的患者PFS时间最短6.5个月, 其次伴有15个核苷酸缺失(delE746_A750)的患者(n=42)PFS是12.4个月, 最长的是插入/替代突变的患者(n=12)PFS 22.3个月(P=0.012)。再分析显示19 Del开始于密码子E746位点的患者(n=46)比开始于E747位点的患者(n=16)PFS更长, 14.2个月 vs. 6.5个月(P=0.021)。21外显子L858R突变患者PFS好于L861R/L861Q, 11.4个月vs. 2.1个月(P=0.034)。Shigematsu教授研究伴有19 Del和L858R突变的62名术后NSCLC患者(各31例), 没有接受EGFR-TKI治疗, L858R突变患者获得更长的生存(P=0.05)[11]。这些研究提示我们, 即使同一外显子的不同突变位点, 患者的生存和治疗反应也存在差异。
目前我们还缺少足够的数据来解释19 Del和21 L858R二者的差异, 有研究者对其中的机制做了解说假设[4, 7]。假说一, 19 Del和21 L858R这两个常见突变位点可能与TKI的亲和力不同, 但是体外细胞系研究显示TKI的抑制浓度一样[12, 13]。假说二, L858R突变可能更易与T790M耐药突变并存, 但临床数据不支持[14, 15], 19 Del和21 L858R合并T790M突变比例相似。假说三:21 L858R突变更容易合并其他少见突变, 影响TKI对21 L858R的敏感性。Hata等[16]回顾分析了783例NSCLC患者的复合突变率, 主要为21 L858R合并G719S(n=8), 吉非替尼对该复合突变反应更差。但是复合突变比率少, 不足以解释临床现状。
综上所述, EGFR突变不同的分子亚型, 甚至同一外显子、不同突变位点的NSCLC可能也不是临床性质完全相同的一组疾病, 未来可能需要针对不同的EGFR突变患者开展比较研究, 最终实现更加精准的个体化治疗。目前还没有足够证据支持我们改变NSCLC的19 Del和21 L858R突变患者的临床治疗决策。正在进行的LUX-Lung 7研究可能为这个问题的解决提供重要依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|