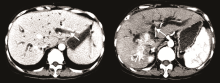
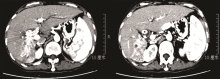
女性患者, 50岁。因“ 确诊肝癌6年余, 身目黄染1周” 入院。患者2007年7月外院体检情况为甲胎蛋白 94.15 ng/mL, B超示右肝实质性占位病变, CT亦示肝占位性病变, 考虑肝癌。2007-07-23我院MRI示:肝S8段占位, 大小为35× 27 mm, 考虑小肝癌可能性大。外科会诊后认为可行肝切除术, 因患者不同意外科手术治疗, 遂于2007-07-26行肝动脉化疗栓塞术, 2007-09-17行无水酒精注入术, 术后CT示S8段病灶内碘油沉积密实。2007年9月至2013年7月(68个月)间规律复诊, 当地医院复查CT示肿瘤病灶稳定。按实体瘤的疗效评价标准评价为疾病稳定。2013年9月外院MRI示肝S8段肿瘤复发, 于2013-09-17行肝动脉化疗栓塞术治疗。2013年10月患者因“ 身目黄染1周” 再次入院。总胆红素369.7 μ mol/L, 结合胆红素180.4 umol/L。2013-10-17我院CT示:肝内外胆管明显扩张, 胆总管上段内见软组织密度肿块影, 大小为25× 26 mm。右肝癌治疗后改变, 考虑右肝后叶肿瘤复发, 肿块累及胆总管且肝内外胆管明显扩张, 见图1。
李勇(介入科主治医师):汇报病例特点(略)。本次讨论的要点为:(1)肝癌合并恶性胆道梗阻治疗的方案选择; (2)进一步的抗肿瘤治疗方案。
陈晓明(介入科主任医师):该患者为肝癌行介入治疗后生存时间超过5年的肝细胞癌患者, 目前为肿瘤复发合并胆道癌栓形成。患者肿瘤原发灶病变相对于胆道梗阻情况来说并不是很重, 主要的问题是胆道癌栓侵犯引起梗阻性黄疸的症状。目前在局部肿瘤复发加上胆道梗阻的情况下, 如何选择治疗方案?
马冬(肿瘤内科主任医师):肿瘤中晚期的患者恶性胆道梗阻比较常见。恶性胆道梗阻目前至少可分为两种类型:一种是由于肿瘤压迫胆道引起的胆道梗阻, 另一种是胆道癌栓侵犯引起的梗阻。是否针对不同原因的胆道梗阻应有不同的方案选择, 是值得进一步探讨的问题。内科保守治疗, 如护肝退黄只是作为最基础的治疗, 针对肿瘤压迫引起的恶性胆道梗阻, 我的建议是经皮经肝胆道穿刺引流术(percutaneous transhepatic cholangial drainage, PTCD)引流加金属支架, 临床上也曾取得了良好的疗效。但是针对由于胆道癌栓引起的胆道梗阻, 是否在PTCD引流的基础上能对癌栓进行处理尚不清楚。如果能通过介入技术对癌栓进行处理, 那么是否放置金属支架也是可以再权衡的?
曹小龙(肿瘤内科主任医师):我认为单纯的外科治疗和单纯的内科保守治疗都是不可取的。该患者目前肝功能评分为9分, 总胆红素高于正常值上限3倍, 凝血功能也存在问题, 行外科手术治疗风险较大, 且局部肿瘤复发患者行外科治疗本身也不符合治疗指征。而单纯的内科保守治疗亦不可取, 患者如果通过PTCD加金属支架治疗后, 肝功能情况及胆红素指标调整至正常水平后, 仍可选择全身化疗或靶向治疗。所以我认为目前还是应该通过介入手段对患者胆道梗阻情况进行治疗后再对原发灶进行处理。
李伟雄(放疗科主任医师):目前针对胆道恶性梗阻的放疗效果并不理想, 而且如果不对梗阻性黄疸进行处理, 黄疸进一步加重所导致的后果也是不堪设想的。国内有学者对下腔静脉癌栓进行放疗, 但是对胆道相关癌栓的放疗目前所做的研究很少, 同时还涉及到放射剂量及范围的问题。所以传统的放疗在该患者身上能起到的效果是微乎其微的。
陈晓明:如果癌栓局限于门静脉或胆道, 放疗的效果如何?
李伟雄:门静脉癌栓的局部放疗目前是研究热点, 也取得了一定的临床效果。但是对于肝功能状况较差的这种恶性胆道梗阻, 放疗的作用还是较为局限的。目前有研究机构利用碘125、碘133等进行粒子植入治疗的, 也证明有一定的效果。
陈晓明:目前该患者肝癌伴恶性胆道梗阻的诊断是明确的。目前临床上都有哪些治疗方案可供选择?
陆骊工(介入科主任医师):针对该病例, 我认为大致有三个方面的治疗方案:①内科保守治疗; ②外科治疗; ③介入治疗。内科治疗如退黄护肝等治疗方法, 外科是否能行手术治疗呢?介入治疗如上所述可选择PTCD引流退黄以及胆道金属支架置入术等再开通胆道的方法。
旁述:恶性胆道梗阻由胆道恶性肿瘤和外源性压迫所致, 临床表现为黄疸、 瘙痒及肝功能衰竭等, 绝大部分为无法手术切除的晚期患者。此病的主要治疗进展为内镜下或经皮经肝穿刺胆汁引流、内支架置入、 放射性粒子植入及光动力等介入治疗[1]。目前针对恶性胆道梗阻的治疗, 主要有以下方案:(1)保守性内科利胆退黄治疗。(2)外科手术治疗:①根治性手术, 即肝细胞癌切除+胆管癌栓取除术或肝细胞癌切除+肝外胆管切除术; ②姑息性手术, 即单纯胆管切开取癌栓+T管引流术, 肝动脉结扎术对于术前或者术中发现肝细胞癌广泛转移无法切除、肝功能较差无法耐受大型手术者, 可行此姑息性手术。(3)减黄手术:目前常用的减黄手段包括经内镜胆道内支架置入术(endoscopic retrograde biliary drainage, ERBD) 和经皮胆道内支架置入术两种。(4)放射性粒子植入是近年来治疗恶性肿瘤的有效方法之一。原理是将微型放射源, 如碘125 放射性粒子植入肿瘤内或受肿瘤侵犯的组织中, 通过放射性核素持续释放低能量射线, 最大程度地杀伤肿瘤细胞。放射性粒子植入为一般情况差、 不能手术的患者提供了生存的机会[2, 3]。
吴一龙(肿瘤学教授):恶性胆道梗阻由胆道恶性肿瘤和其他肿瘤外源性压迫所致, 在肿瘤患者, 特别是晚期肿瘤患者中是经常碰见的难题。
近期我们肿瘤科也有几个类似的病例, 多数是以PTCD联合金属支架置入减黄, 解决胆道梗阻的症状后再对肿瘤原发病灶进行治疗的。
李勇:针对该病例, 我们选择的也是先处理胆道梗阻, 进一步明确恶性胆道梗阻的类型, 是肿瘤压迫还是癌栓侵犯胆道。减黄手术就介入治疗来说, 无外乎胆道引流以及金属支架置入术。关于胆道引流, 选择PTCD还是经内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)也是目前争议较大的问题。
吴一龙:关于PTCD还是ERCP的问题我们也讨论过多次。
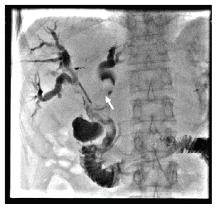
李勇:总体来说, PTCD的普适性较好, 若ERCP失败后仍可选择行PTCD治疗。因此针对该患者我们选择的是先行PTCD处理治疗。从图2的患者术中胆道造影图像可见:左肝内胆管扩张, 呈藤蔓状改变, 右肝胆管、胆总管未见造影剂充盈。左右肝管汇合区及胆总管上段见巨大充盈缺损, 相对应胆管不规则扩张, 少许造影剂可进入十二指肠。根据患者病例特点及影像学资料, 可诊断为局部肿瘤复发合并胆道癌栓形成。
陈晓明:目前肝癌伴胆道癌栓形成的诊断得以明确。根据影像学资料结合数字减影血管造影不难看出该患者胆道梗阻情况为胆道内癌栓形成导致。针对这种情况, 如果只是单纯地予以减黄对症治疗, 治疗效果不能保证, 复发率也相对较高。
李勇:目前国内有学者针对肝癌门静脉癌栓及胆道癌栓行碘125粒子内放射治疗。制作碘125粒子条或定制粒子依附支架对门静脉癌栓或胆道癌栓进行减黄再通的同时对肿瘤癌栓进行治疗。参考目前已有的治疗方案, 我们针对肝癌伴胆道癌栓给患者设计了碘125粒子条联合胆道金属支架的治疗方案。
吴一龙:有没有研究资料能证明该方案是有效可行的?
陈晓明:首先碘125粒子治疗针对肝癌的有效性是得到多项临床试验验证的。粒子条技术在门静脉癌栓的治疗中也是比较成熟的。碘125粒子条作为一种低剂量放射源可持续性照射植入粒子近程(放疗), 有以下特点:粒子所产生的辐射在短距离内衰减, 减少对正常组织及临近器官的损害; 粒子连续发射伽玛射线, 半衰期较长, 这些可导致肿瘤干细胞发生凋亡; 植入碘125粒子产生的辐射不受呼吸运动的影响; 低剂量连续辐射可改变肿瘤的免疫表型而减少肿瘤发生转移。超声研究表明恶性胆道梗阻患者胆道主干经PTCD引流后直径为8~14 mm, 粒子组织间辐射半径为17 mm。因此植入粒子治疗恶性胆道梗阻理论上是可行的。由于经皮穿刺靶病灶可并发腹腔内出血、误损伤胆道, 植入的粒子容易发生移位而且单纯植入碘125粒子大多数情况下不能达到梗阻的胆管部位发挥作用。而支架联合粒子条技术有效地解决了这一系列问题。
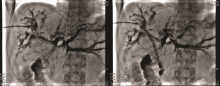
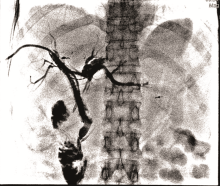
李勇:最终我们选择的治疗方案是胆道支架置入术联合碘125放射性粒子条治疗。如图3所示, 通过前期手术留置的PTCD引流管引入粒子条, 粒子条远端进入左肝管的一个主要分支、近端位于右肝管内; 从留置血管鞘应用双导丝引入一根超滑硬导丝, 沿硬导丝在左右肝管送入80 mm× 8 mm胆道支架一枚。利用支架膨胀张力使留置粒子条固定在胆道内, 然后引入导丝经已放置金属支架网眼进入胆总管、十二指肠, 建立轨道; 使用80 mm× 6 mm球囊扩张支架网眼后引入6F-Guide导管至胆总管中段, 沿导管送入一内装碘125的粒子条; 沿硬导丝在右肝管-胆总管送入80 mm× 8 mm胆道支架一枚。术后造影如图4所示。术前术后对比可以看到术后胆道情况明显好转。术后1个月复查CT(图5)示:与术前比, 肝内部分胆管轻度扩张, 以右叶为著, 左右肝管至胆总管下段内见支架植入, 支架内未见明显软组织影充填。
术后1个月复查总胆红素 37 μ mol/L, 结合胆红素19.9 μ mol/L(图6)。肝功能Child-Pugh评分为7分B级。
吴一龙:患者术后甲胎蛋白有没有下降?
李勇:该患者术前术后甲胎蛋白指标都在正常范围内。但是患者肝细胞癌的诊断是明确的。
李伟雄:粒子条的剂量和放置位置是根据什么来确定的?胆道梗阻情况改善, 肝功能情况恢复后是否针对原发灶进行处理?
陈晓明:根据术前CT影像资料及胆道造影, 对癌栓位置及粒子照射范围进行术前计划, 我们有专门的粒子计划系统进行严格的评估。
陆骊工:胆道梗阻情况缓解后患者肝功能状况明显好转。目前可选择肝动脉化疗栓塞术及局部消融针对原发病灶进行治疗。胆道癌栓及梗阻的处理为患者下一步的治疗打好了肝功能的基础, 争取了治疗的时间。
旁述:放射治疗是指利用同位素的射线及加速器产生的高能X 线、电子束、质子、快中子以及其他重粒子等治疗肿瘤的方法。一般放疗有两种照射方式, 一种是远距离照射, 即将放射源与人体保持一定的距离进行照射, 射线从体表穿透进入体内一定深度, 达到治疗肿瘤的目的; 另一种是近距离放疗, 亦称之为内放射治疗, 是指采用介入的方法将放射性物质直接注入肝动脉或将放射性物质植入瘤体内, 加强了放疗的靶向性和治疗效果, 因其简单安全有效, 逐渐成为一种新型的治疗方法。同时内放射与其他治疗方法联合应用也取得了一定的临床效果, 如门静脉金属支架联合粒子条治疗等[3]。
目前用于临床治疗肝癌及其癌栓的核素主要有碘125、碘131、磷32等[4]。AI粒子是目前肝癌治疗中最常用的一种放射线核素, 单个放射性活度为0.3~1.0 mCi, 其半衰期为60.2天, 能量为27.4~31.4 Kv(X线)、35.5 Kv(γ 射线)。其最大体内照射范围约1.7 cm, 便于保存, 同时对患者及医务人员损伤较小。碘125粒子植入治疗肝细胞癌能够增加靶区域曝光的剂量, 同时减少周围正常组织的受照剂量, 可以提高肿瘤的局部控制率以及患者的生存率。癌栓组织学表现可分为3 种类型:增殖型、坏死型、机化型。早期癌栓以对射线较敏感的增殖型为主。碘125放射性粒子释放出X 射线和γ 射线可致细胞核DNA 损伤:(1)直接作用, γ 射线使细胞核DNA 双链、单链断裂。(2) 间接作用, 射线使水分子电离, 产生自由基与生物大分子相互作用, 再作用于DNA 链, 引起DNA 损伤, 进而抑制肿瘤细胞增殖。增殖期细胞被损伤后, 处于非增殖期和细胞周期G0 期的细胞进入敏感的G2 或M期而被损伤, 进而不断消耗肿瘤干细胞。P53 基因是一种定位于人17 号染色体短臂的一种肿瘤抑制基因, 碘125 放射性粒子释放的X射线和γ 射线可上调P53基因的表达, 增强对肿瘤的抑制作用; 近距离放疗可降低Bcl-2基因的水平, 从而缩短肿瘤细胞寿命, 加速细胞凋亡; Bax基因一方面通过过表达启动凋亡信号, 另一方面可抑制Bcl-2 基因, 碘125放射性粒子植入肿瘤组织后, Bax水平可升高, 从而诱导细胞凋亡; 近距离放疗通过消除血管内皮生长因子的作用、抑制内皮细胞生成和迁移、抑制基底膜的降解等机制, 从而抑制肿瘤的生长。
吴一龙:总结今天的病例讨论, 本病例诊断为肝癌伴胆道癌栓形成, 根据患者术前术后的情况来看, 碘125粒子联合胆道支架治疗肝癌伴恶性胆道梗阻的治疗方案短期疗效是可观的。碘125粒子局部放射治疗对于此类病患的疗效期待进一步的验证和研究。
对于肿瘤治疗, 如果目前有指南或指引, 大家要尽可能参照, 如果没有相对应的指南, 也要寻找证据水平较高的临床研究作为指导。当然, 目前现有的指南都是没办法令我们满意的, 所以如果有好的想法、好的临床思路可以尝试, 前提是要充分分析, 科学地设计临床研究来做。
针对该病例, 通过对胆道梗阻的处理为下一步治疗争取了时间, 后期可选择肝动脉化疗栓塞或局部消融的方法进行治疗。同时需要密切监测胆道内癌栓有无进一步发展, 是否得到有效控制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|