| 杜欣, 主任医师、教授、博士研究生导师, 广东省人民医院血液科行政主任。多次在美国MD. Anderson Cancer Center白血病科、淋巴瘤骨髓瘤科进修学习。承担多项国家自然科学基金、广东省自然科学基金、广东省科技计划项目、广州市重大科技专项计划项目及临床试验研究。现任广州干细胞联盟副理事长; 广东省中西医结合学会血液病专业委员会主任委员; 国家科学技术进步奖评审专家; 国家自然科学基金评审专家; 中华医学会肿瘤学分会淋巴瘤专家工作组成员; 中华医学会血液学分会红血组专家组成员; 白血病淋巴瘤诊治指南制订专家; 《中华血液学杂志》通讯编委、《国际输血及血液学杂志》、《循证医学》、《肿瘤防治研究》、《临床内科杂志》编委。 |
收稿日期:2015-03-30
研究一: Pleyer L, Burgstaller S, Girschikofsky M, et al. Azacitidine in 302 patients with WHO-defined acute myeloid leukemia: Results from the Austrian Azacitidine Registry of the AGMT-Study Group[J]. Ann Hematol, 2014, 93(11):1825-1838.
研究二:Mayer J, Arthur C, Delaunay J, et al. Multivariate and subgroup analyses of a randomized, multinational, phase 3 trial of Decitabine vs treatment choice of supportive care or Cytarabine in older patients with newly diagnosed acute myeloid leukemia and poor- or intermediate-risk Cytogenetics[J]. BMC Cancer, 2014, 14: 69.
1b。
老年急性髓系白血病(acute myeloid leukemia, AML)患者, 由于年龄大, 疾病状态差, 又常合并其他疾病和/或不良核型, 故往往不能耐受传统化疗或异基因造血干细胞移植。去甲基化药物, 包括阿扎胞苷和地西他滨给老年患者带来了新的曙光。临床试验AZA-001及NCT01074047佐证了阿扎胞苷对于AML患者的疗效, 而另一项多中心、随机开放的Ⅲ 期研究也证实了对于≥ 65岁的老年AML患者, 地西他滨治疗较传统治疗安全有效。目前, 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)已建议阿扎胞苷或地西他滨作为AML的一项治疗选择。
尽管如此, 去甲基化药物对于AML的预后因素尚未明确。鉴于此, 研究进一步扩大了AML患者的病例数(n=302)并进一步更新阿扎胞苷的疗效及安全性数据以辨别出潜在的预后因子。研究者亦在大型的多中心、随机开放的Ⅲ 期临床试验的基础上, 进一步进行亚型分析, 从而判别出地西他滨对于老年AML的潜在预后因素及疗效。
评估去甲基化药物(阿扎胞苷和地西他滨)在AML患者(尤其是老年患者)中的预后因素及安全有效性。
研究一:
• 研究条件:澳大利亚共14个中心参与。
• 研究时间:2009年2月至2013年12月, 生存时间分析截止日期为2014年1月21日。
• 研究方法:多中心、开放性、前瞻性研究。
• 研究对象:所有AML的患者, 不管年龄大小, 有无并发症或接受阿扎胞苷前有无化疗, 即没有特殊的排除标准。
• 干预措施:共入组302例AML患者, 予以阿扎胞苷治疗。其中15%的患者接受75 mg/m2、d1~d5, 53%的患者接受100 mg/m2、d1~d7。
• 评价指标:主要终点指标是疗效评估, 次要终点指标为安全性分析(包括毒性及不良事件)、生存时间和影响生存的预后指标。
研究二:
• 研究条件:15个国家的65个中心参与。
• 研究时间:2006年1月至2009年4月, 生存时间分析截止日期为2010年10月。
• 研究方法:多中心、开放性、前瞻性研究。
• 研究对象:入选标准:年龄≥ 65岁, 原始细胞> 20%的初诊或继发AML, 核型中危或差, ECOG评分为0~2分。排除标准:t(15; 17)核型异常, t(8; 21)核型异常, inv(16)核型异常。
• 干预措施:根据患者年龄、细胞遗传学及ECOG评分, 以1∶ 1比例随机分配至地西他滨组或其他治疗组。前者接受地西他滨20 mg/m2静脉注射、d1~d5, 4周为一疗程; 后者根据患者需求, 给予支持治疗或阿糖胞苷20 mg/m2皮下注射、d1~d10, 亦是4周为一疗程。当患者出现疾病复发、疾病进展、死亡、无法耐受的毒性、丧失临床疗效、需额外干预的并发症或患者/临床医生主动要求, 即为治疗终点。
• 评价指标:主要评价指标是生存时间, 次要评价指标是根据骨髓穿刺活检结果比较二者的反应率(包括完全缓解和血小板未恢复的完全缓解)。
研究一:
患者特征:主要为老年患者, 中位年龄为73岁(30~93岁), 且40%的患者年龄大于75岁, 21%的患者年龄大于80岁, 8%的患者年龄大于85岁。172例(57%)患者的原始细胞数> 30%, 57例(19%)患者核型不良, 另201例(67%)患者核型为中危。
疗效:阿扎胞苷对于AML患者的总反应率(包括完全缓解、骨髓完全缓解、部分缓解、血液学改善)为48%, 其中完全缓解/骨髓完全缓解率为17%。中位反应时间为3个月, 中位反应持续时间为3.4个月(0.3~33.0个月), 首次发生反应至最佳反应的中位时间为3.5个月(0.8~21.5个月)。
安全性:所有患者在总共接受2 013个疗程过程中, 共发生1 031次不良事件, 其中24%的不良事件与阿扎胞苷药物相关, 而在3~4级不良事件中, 20%与药物相关。最主要的3~4级不良事件为药物引起的骨髓抑制, 其中3~4级中性粒细胞减少、血小板减少及贫血的发生率分别为35%、30%及28%。非血液学毒性的症状通常较轻, 最常见的是疲劳(39%), 胃肠道反应(38%), 非特定的疼痛(30%)及注射部位反应(22%)。但仍有33例(11%)患者发生3~4级非血液学毒性, 主要来自心血管系统, 占83%。此外, 3~4级感染的发生率约为33%, 主要是肺部感染、败血症及不明原因的发热。
生存时间及潜在的预后指标:
平均生存时间为9.6个月(95%可信区间 8.53~10.7个月), 有效患者的平均无进展生存时间为9.1个月(95%可信区间0.9~39.9个月), 且有效患者的平均总生存期明显长于无效患者(16.1个月 vs. 3.7个月)。
研究分析发现, 性别, 年龄(< 75岁vs.≥ 75岁、< 80岁vs.≥ 80岁), WHO-AML分型, WBC(< 10 G/L vs.≥ 10 G/L、< 15 G/L vs.≥ 15 G/L、< 30 G/L vs.≥ 30 G/L), 中性粒计数(< 1 000/uL), 淋巴细胞计数(< 2 000/uL), 骨髓原始细胞(≤ 30% vs. > 30%), 血红蛋白浓度及接受阿扎胞苷治疗前有无接受ESA、G-CSF、低剂量阿糖胞苷或羟基脲均不影响患者的总生存期。而多因素分析发现, LDH≥ 225 U/L、ECOG≥ 2分、患者并发症≥ 3项、单倍染色体、阿扎胞苷作为一线治疗、用药后血液学改善及用药后发生首次反应后疗效进一步改善, 则显著影响患者的生存期, 具体见图1。
研究二:
• 患者特征:共485例患者入组, 其中242例患者接受地西他滨治疗, 243例患者接受其他选择治疗(包括支持治疗28例和阿糖胞苷215例), 且两组患者的临床特征和信息相似。约71%的患者年龄≥ 70岁, 继发性AML占35.3%, 核型差的AML占36%, ECOG评分为2分的患者占25.8%, 中位骨髓原始细胞为46%。
• 对生存时间的预后分析结果
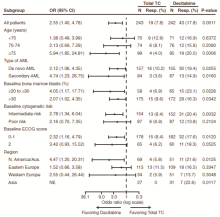
多因素分析发现, 地西他滨较选择治疗组(阿糖胞苷或支持治疗)能延长患者的生存时间[风险比(hazard ratio, HR)=0.799], 且各个亚组分析均显示出地西他滨较选择治疗组的优越性, 具体如图2所示。此外, 患者年龄小(HR=1.56, ≥ 75岁 vs. < 70 岁, P=0.001 0)、ECOG评分低(HR=0.771, 0或1分 vs. 2分, P=0.032 1)、核型好(HR=0.699, 中危vs. 差, P=0.001)、原始细胞少(HR=1.355, > 50% vs. ≤ 50%, P=0.004 5)、血小板计数高(HR=0.775, > 100× 109/L vs. ≤ 100× 109, P=0.001 5)或白细胞计数低(HR=1.256; > 25× 109/L vs. ≤ 25× 109/L, P=0.001 5)亦是延长患者生存期的有利因素。且研究发现来自西欧地区的患者较其他地区的患者生存时间长。
• 对地西他滨反应率的预后分析结果
对所有的年龄组, 地西他滨反应率均无影响, 即年龄< 70岁、70~74岁、> 75岁的AML患者均可以接受地西他滨治疗。而对于初诊AML患者、原始细胞数为20%~30%的患者、核型中危的患者、ECOG评分为2分的患者, 更适合接受地西他滨治疗。
对于AML患者, 尤其是无法耐受化疗或丧失移植机会的老年患者, 去甲基化药物是一个良好的治疗选择, 预后因素分析筛选出了哪一类患者更适合此类去甲基化药物。
据2010年的全国人口普查结果显示, 中国有1.19亿≥ 65岁老年人, 约占全国总人口的8.87%, 我国已经进入老龄化社会。而AML好发于老年人, 中位发病年龄为65~70岁。美国65岁以上人群的发病率达17.6/10万, 35%新诊断的AML患者年龄≥ 75岁。随着人口的老龄化, AML的发病率将会进一步增高。而老年AML患者化疗完全缓解(complete response, CR)率低、早期病死率高, 长生存率低、预后差, 尚缺乏统一有效的治疗策略。而近年来, NCCN、欧洲白血病网和欧洲肿瘤内科学会推荐对老年AML使用去甲基化药物治疗, 包括阿扎胞苷与和地西他滨。
阿扎胞苷, 为胞苷的5-氮杂类似物, 属于一类被称为低甲基化药物的表观遗传学抗肿瘤药, 最早由捷克斯洛伐克科学家Piskala和Sorm合成[1], 而后又从拉达克链轮丝菌发酵液中分离得到[2]。其先后成为美国FDA批准上市的骨髓增生异常综合征(myelodysplastic syndrome, MDS)药物、欧盟批准的可显著延长中危-2和高危MDS和AML患者总生存期的治疗药物及日本新药株式会社上市的治疗MDS的药物。随后, 多个临床试验证实了阿扎胞苷在高危MDS及AML患者中的显著疗效及安全性[3, 4], 更佐证了阿扎胞苷较传统治疗能延长原始细胞为20%~30%的老年AML患者的总生存时间[5]。此后, Pleyer等发现在所有的AML患者中, 即不管骨髓原始细胞是否介于20%~30%之间抑或 > 30%, 阿扎胞苷均能取得良好的疗效且毒性可控[6]。研究一是在上述Pleyer的研究基础上, 进一步扩大样本量达302例, 并延长患者随访期, 是目前为止所知样本量最大的一个Ⅲ 期临床试验。该试验结果进一步证实, 无论AML患者骨髓原始细胞数多少, 阿扎胞苷安全有效, 尤其对于无法耐受化疗或丧失移植机会的老年白血病患者, 阿扎胞苷无疑是一个有效的治疗选择。另外, 对患者生存时间进行统计分析, 发现了能预测患者生存期的潜在预后指标, 并排除了一些不能预测生存期的指标。对患者治疗预后有一个很好的评估, 能帮助临床医师判断/选择哪些患者适合接受阿扎胞苷治疗。但遗憾的是, 该研究缺乏随机对照组, 若能同时设计传统治疗组和/或对症支持治疗组, 则该研究更具有说服力。
地西他滨, 亦是一种天然的脱氧胞苷酸的腺苷类似物, 低浓度的地西他滨掺合可替代肿瘤内的胞嘧啶与DNA甲基化转移酶共价结合, 使DNA甲基化转移酶失活, 从而达到去甲基化的作用。一项发表在JCO的Ⅰ 期临床试验初步显示地西他滨对AML安全有效, 总反应率约44%, 且提示其最佳生物剂量为20 mg/m2 [7]。随后, Ⅱ 期临床试验入组了55例老年AML患者, 结果提示患者的CR率为24%, 主要不良事件为骨髓抑制、中性粒细胞减少及疲倦, 佐证了地西他滨对于急髓的安全可耐受性[8]。而体外实验更进一步证明了地西他滨对于AML细胞株的抗肿瘤作用[9, 10]。一项多中心、随机性、开放性的Ⅲ 期临床研究比较了地西他滨与低剂量阿糖胞苷或支持治疗(选择治疗组)的安全有效性及生存期。结果显示地西他滨组患者较选择治疗组取得更高的CR率+病理学CR率, 分别为17.8%和7.8%(P=0.001), 两组达到最佳缓解的中位时间分别是4.3个月(95%可信区间3.8~5.1个月)和3.7个月(95%可信区间2.8~4.6个月), 而两组对治疗的耐受性比较亦显示地西他滨治疗组的耐受性良好。随访至2010年10月, 地西他滨组显示出较选择治疗组更长的生存期(P=0.037)。而研究二是在该Ⅲ 期临床试验基础上做的预后分析, 结果提示患者年龄小、ECOG评分低、核型好、原始细胞少、血小板计数高或白细胞计数低均是患者生存期的有利因素。
综上所述, 目前多项临床试验结果均充分肯定了去甲基化药物在老年AML中的疗效、安全性及可耐受性, 并能延长患者总生存期, 提高缓解率, 从而改善老年患者的预后。而进一步的预后因素分析筛选出了哪一类患者更适合此类去甲基化药物, 这对临床医生在判断是否给予患者去甲基化药物时提供了一定的循证医学依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|