| 李军民教授, 现任上海交通大学医学院附属瑞金医院血液科主任、主任医师、博士研究生导师。兼任中华医学会血液学分会委员兼秘书, 上海血液学分会副主任委员, 中华医学会内科学分会青年委员,先后于上海交通大学医学院(原上海第二医科大学)师从王振义院士获得硕士及博士学位。1996-1997年赴巴黎第七大学血液和血管研究所、2001年4月至9月赴美国MD Anderson肿瘤中心做访问学者。长期从事血液专业的临床医学工作, 对血液系统恶性肿瘤和血液免疫疾病的治疗具有丰富临床经验, 取得了一系列创新性研究成果, 在国际、国内重要学术期刊上发表论文50余篇。承担了包括国家“ 973” 子课题、国家“ 863” 子课题、卫生部行业专项、国家教委骨干教师项目、国家自然科学基金面上项目、上海市科委重大研究项目等多项课题。获得上海科技进步三等奖、教育部科技成果二等奖和上海医学科技一等奖等奖项共6项。 |
收稿日期:2015-04-03
Garcia-Manero G, Gartenberg G, Steensma DP, et al. A phase 2, randomized, double-blind, multicenter study comparing Siltuximab plus best supportive care (BSC) with placebo plus BSC in anemic patients with International Prognostic Scoring System low-or intermediate-1-risk myelodysplastic syndrome[J]. Am J Hematol, 2014, 89(9):e156-e162.
1b。
大部分中低危骨髓增生异常综合征(myelodysplastic syndrome, MDS)患者以贫血为主要症状, 且伴有输血依赖, 而此类患者常伴发铁过载且生存期较短。目前研究发现, MDS患者的白介素6(IL-6)水平明显高于健康人群或其他骨髓衰竭性疾病, 且体外实验证明它能促进原始细胞增长、介导MDS疾病进展。Siltuximab为抗IL-6的单克隆抗体, 已证实其能显著提高卡斯特莱曼病和肾细胞癌患者的血红蛋白水平, 且不良事件少。
评估Siltuximab对于中低危MDS患者(IPSS评分为低危及中危-1的MDS患者)的疗效及安全耐受性。
• 研究条件:4个国家的10个中心。
• 研究时间:2011年11月到2012年7月。
• 研究方法:多中心、随机对照、前瞻性Ⅱ 期临床研究。
• 研究对象:年龄> 18岁的中低危MSD患者, 即IPSS评分为0/0.5/1分; 签署知情同意书前8周内输注红细胞量≥ 2 u; 铁储存充裕, 即骨髓中存在可染铁或血清铁蛋白水平> 100 ng/mL; ECOG评分为0~2分; 典型的贫血症状; 血小板计数> 20 × 109/L; 肝肾功能正常。
• 干预措施:患者按2∶ 1的比例随机分为两组:一组接受Siltuximab治疗15 mg/kg, 静脉注射1小时, 每4周为一疗程, 同时予以最佳支持治疗; 另一组接受同等剂量的安慰剂治疗, 每4周为一疗程, 同时亦予以最佳支持治疗。两组患者接受双盲试验持续12周后进行疗效评估, 对于安慰剂组治疗失败的患者及Siltuximab组治疗有效的患者改成或继续接受Siltuximab治疗。
• 评价指标:主要评价指标为Siltuximab的疗效, 即能否减少伴有贫血的MDS患者的输注红细胞次数(红细胞输注减少定义为双盲试验前8周红细胞输注次数较签署知情同意书前8周的红细胞输注次数≤ 50%或≥ 2 u)。次要评价指标包括输注红细胞的量、无需输注红细胞患者的比例、血红蛋白的改变、疾病进展、药物的安全性或耐受性、Siltuximab的药代动力学分析及药效分析(IL-6、C反应蛋白、铁调素、瘦蛋白、骨形成蛋白6、红细胞生成素及TNF-α 血清复合物)。
该研究共纳入76例患者, 其中50例进入治疗组, 26例进入安慰剂组, 中位年龄为72岁(50~85岁), 96%的患者为白种人, 男性患者占58%。两组的骨髓原始细胞及中位血红蛋白相似, 铁蛋白水平都明显升高且具有较高变异性, 两组中均有几乎一半的患者为低危MDS患者, 且在签署知情同意书前8周红细胞输注量小于4 u。而在筛查前16周, Siltuximab组输注红细胞平均值为8.8 u, 安慰剂组输注红细胞平均值为9.0 u。Siltuximab组中80%的患者接受了其他治疗, 而安慰剂组中85%的患者接受了其他治疗。最常用的治疗方案是:促红细胞生成制剂 (68%), 去甲基化药物(39%), 铁螯合剂(36%), 免疫抑制剂(28%, 包括来那度胺、环孢素及抗胸腺细胞免疫球蛋白)。
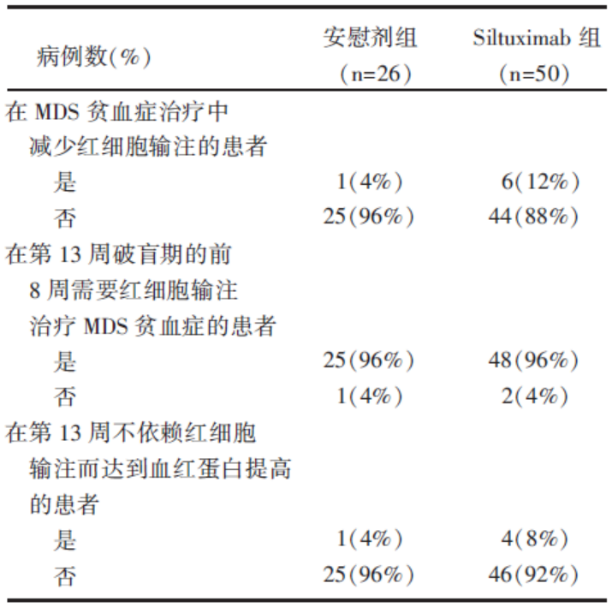
76例患者均接受了至少一次药物治疗, 大部分患者完成了12周持续双盲试验研究(西妥昔单抗组72%, 安慰剂组84.6%), 且15例患者进入破盲期试验, 包括2名Siltuximab组患者和13名安慰剂组患者, 破盲期后中位治疗周期为3(跨度1~5)。在Siltuximab组, 6例(12%)患者红细胞输注减少, 而在安慰剂对照组, 1例(4%)患者红细胞输注减少, 虽然Siltuximab组治疗有效的患者多于对照组, 但两组间差异并无统计学意义(P=0.271)。而在第13周破盲期, 有4例(8%)Siltuximab组患者和1例(4%)对照组患者出现血红蛋白的提高, 但差异仍无统计学意义, 具体见表1。
| 表1 疗效总表 |
另外, 没有任何基线特征和生物标志物能对治疗后有效患者和无效患者进行评估。评估的参数包括:血清IL-6水平、铁调素、C反应蛋白、瘦蛋白、骨形成蛋白、TNF-α 、β 2-微球蛋白、铁蛋白、促红细胞生成素以及IPSS评分、既往输血单位数和疾病持续时间。
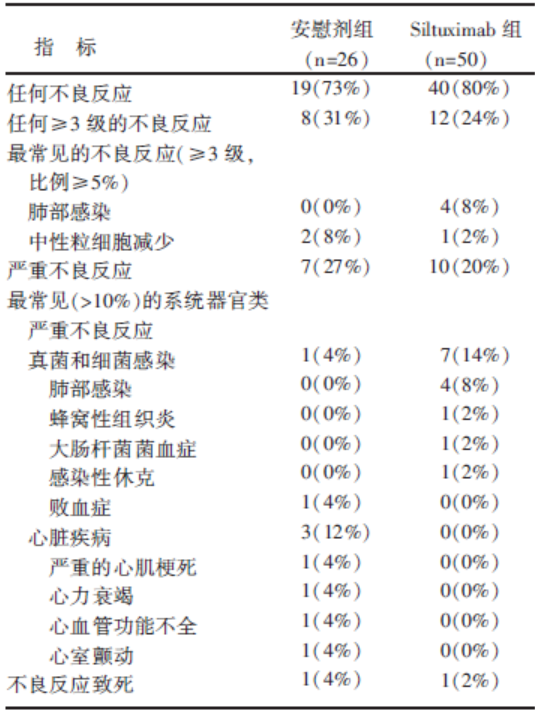
两组中的治疗相关严重不良事件(Siltuximab组20%, 对照组27%)及紧急不良事件(Siltuximab组 80%, 对照组 73%)的发生率相似, 且由于不良事件导致终止研究的发生率都很低[Siltuximab组3例(6%), 对照组2例(8%)]。最常见的紧急不良事件报告(发生率≥ 10%)分别是外周性水肿(Siltuximab组16%, 对照组8%), 背痛(Siltuximab组10%, 对照组8%), 肝功能异常(Siltuximab组10%, 对照组12%), 恶心(Siltuximab组8%, 对照组12%), 手足疼痛(Siltuximab组6%, 对照组12%), 咳嗽(Siltuximab组4%, 对照组12%), 上呼吸道感染(Siltuximab组4%, 对照组12%)。
Siltuximab组的3级以上不良事件发生率明显低于对照组(24% vs. 31%), 而Siltuximab组的3级以上感染的发生率却高于对照组(14% vs. 4%), 且Siltuximab组的患者血小板下降幅度大于对照组, 具体见表2。然而, 仅1例患者因血小板减少导致痔疮出血从而终止研究。此外, 共有5例患者发生输液反应, 其中4例来自Siltuximab组, 1例来自对照组。
| 表2 安全性总表 |
相对于安慰剂组, Siltuximab并没有减少低危和中危-1的MDS患者的红细胞输注。
MDS患者以低、中危为主, 约占总数的2/3, 目前主要治疗手段依然为刺激造血、输血支持以及去铁治疗。据统计其中约一半患者长期依赖输血, 而长期输血所致铁沉积对于患者心脏及肝脏功能影响较大, 其所致功能衰竭已经成为MDS患者的主要死亡原因之一。
研究发现, 部分MDS患者存在IL-6水平升高, 而IL-6可能与介导炎症及相关贫血有关。 Siltuximab作为白介素-6(IL-6)的单克隆抗体在2014年被FDA首次批准用于多中心型卡斯特曼病(multicentric Castleman’ s disease, MCD)的治疗, 使用后发现患者血红蛋白水平出现明显升高。此项由MD Anderson肿瘤中心发起的Ⅱ 期临床试验旨在比较加用Siltuximab是否能够通过中和IL-6, 减轻炎症反应, 改善IPSS低危及中危-1组MDS患者的血红蛋白水平, 减少输血量。
虽然有一定的病理生理学基础机制已经在其他疾病中的成功应用作为该临床试验的支撑, 其结果却未能达到想象中的效果。最终的研究结果显示, 使用Siltuximab的患者与安慰剂组相比, 其输血依赖程度并未获得显著改善, 该研究也因没有获得阳性结果而被提前终止。即使如此, 其中仍有某些现象值得我们进一步探究。
首先, 研究组患者在使用Siltuximab中和IL-6后, 体内C-反应蛋白水平确实出现了明显下降, 同时伴随所需输血量下降, 但是与对照组相比并不存在显著性差异。炎症所介导的贫血确实在MDS患者中存在, 然而阻断炎症反应后是否一定能使得患者贫血得到改善仍是一个需要探究的问题, 可能需要进一步通过基础实验来解答。第二, 研究者发现两组患者在入组此项研究时, 都已经接受了较大剂量的输血治疗, 并且其铁蛋白、IL-6水平均存在较大组内差异。若对入组标准进行严格控制, 仅对IL-6高表达同时铁蛋白水平正常范围的患者进行治疗, 可能会得到不同的结果。第三, 研究组患者普遍对于药物的耐受性较好, 是否可以通过剂量调整获得更好的治疗效果也是值得进一步进行探索研究的。
The authors have declared that no competing interests exist.