| 秘营昌, 主任医师, 博士研究生导师。1990年毕业于山东医科大学, 获医学学士学位。1998年毕业于中国协和医科大学, 获医学博士学位。2000年11月至2003年1月在美国路易威尔大学做博士后研究。多年来一直从事白血病及骨髓增殖性肿瘤的临床与基础研究工作, 参与我国成人急性髓系白血病、急性淋巴细胞白血病的诊断治疗指南、共识的起草。现为中国医学科学院血液病医院白血病诊疗中心副主任, 中华血液学杂志、中国实验血液学杂志、中国实用内科杂志、国际输血与血液学杂志编委, 卫生部抗肿瘤药物合理用药专家组成员。承担多项国家、省部级课题研究, 参编著作10余部。 |
收稿日期:2015-03-06
Stelljes M, Krug U, Beelen DW, et al. Allogeneic transplantation versus chemotherapy as postremission therapy for acute myeloid leukemia: A prospective matched pairs analysis[J]. J Clin Oncol, 2014, 32(4): 288-296.
1b。
阿糖胞苷联合蒽环类药物诱导成人急性髓系白血病(acute myeloid leukemia , AML)的完全缓解(complete response, CR)率已达80%以上, 但是对于老年白血病、伴有不良细胞遗传学核型及分子生物学异常的患者, 其缓解率明显下降。第一次完全缓解(CR1)后的复发风险及总生存率(overall survival, OS)受疾病危险分层的影响, 细胞遗传学危险分层已成为预测AML预后的可靠指标, 对于伴有不良染色体核型的患者, 异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)被认为是缓解后最有效的治疗方法。
虽然allo-HSCT是目前最有效的抗白血病治疗方法, 但其疗效受到非复发死亡率及高移植相关死亡风险的限制, 尤其是合并移植物抗宿主病(graft versus host disease, GVHD)的患者。尚无随机对照研究比较AML患者CR1后不同治疗方案的疗效, 是选择allo-HSCT 或传统化疗仍主要依据是否存在人类白细胞抗原(human leukocyte anti-gen, HLA)相合的同胞供者, 目前已有数个前瞻性、回顾性及Meta分析做过对比研究。然而, 供者组与非供者组之间的比较受到没有同胞供者与没有进行HLA配型却被分为无供者组的影响, 从而导致试验偏差。而且, 这些供者与无供者组的对比研究没有考虑到接受无关供者组移植患者的比例, 目前发现接受良好HLA配型无关供者移植的患者与接受同胞相合供者移植的患者有着相似的生存率。
大多数获得CR的AML患者接受缓解后巩固化疗方案容易出现复发, allo-HSCT可以改善这些患者的预后, 但可能伴有移植相关风险的增加, 目前仍不清楚哪些AML患者接受移植的疗效最好。
比较接受相合同胞及无关供者移植与传统化疗(两种缓解后治疗方案)的疗效。
• 研究条件:德国多中心临床研究项目(AMLCG99)。
• 研究方法:多中心随机对照研究。
• 研究时间:1999-2011年。
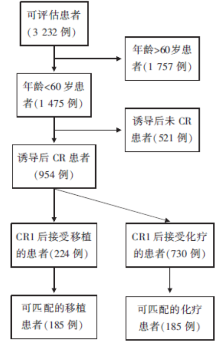
• 研究对象:185例配对的年龄在16~60岁的初诊AML及骨髓原始细胞> 10%的MDS患者。
• 干预措施:患者随机分组后分别接受传统化疗方案及allo-HSCT方案治疗, 具体流程图见图1。
• 评价指标:主要评价指标为OS, 次要评价指标为无复发生存率(relapse-free survival, RFS), 非复发死亡率(non-replase mortality, NRM)。
移植组与传统化疗组相比, 预计7年OS分别为58%及46%(P=0.037), RFS分别为52%及33%(P< 0.001), NRM分别为24%及6%(P< 0.001), 复发率分别为36%及65%(P< 0.001)。危险分组分析显示, 不伴有良好染色体核型的患者、年龄超过45岁的患者、继发性AML患者、高危MDS患者接受移植的OS更佳。多因素分析显示CR1后治疗方案的选择是影响OS的独立预后危险因素(allo-HSCT vs. 化疗的风险比0.66, 95%可信区间0.49~0.89), 患者的年龄、细胞遗传学分型、骨髓原始细胞数量也与预后有关。
allo-HSCT是目前最有效的缓解后治疗方案, 尤其是对于年龄在45~59岁之间、伴有高危细胞遗传学核型的患者疗效更佳。
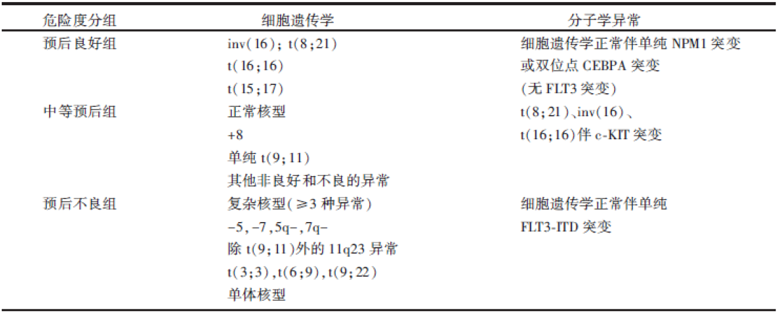
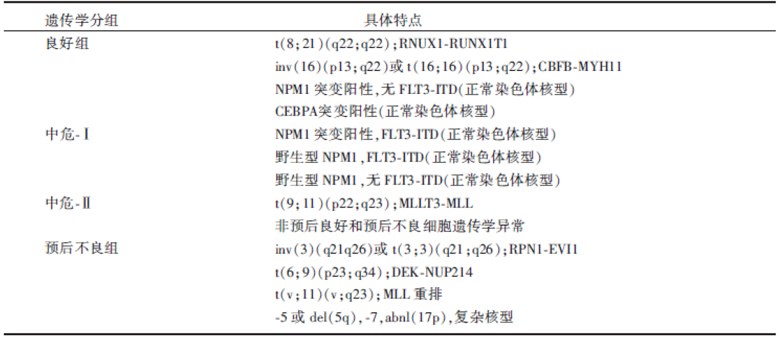
AML是成人最常见的急性白血病, 是一种异质性很大的疾病, 疗效受多种因素影响, 如年龄、并发症、体能状态、疾病特征(包括原发、治疗相关性、继发于骨髓增生异常/骨髓增殖性肿瘤等), 但最重要的还是遗传学资料。AML的遗传学异质性包括细胞遗传学和分子学的异质性, 遗传学结果既可用于疾病的诊断分型, 也可用于疾病预后的判断、指导治疗方案/策略(包括诱导缓解治疗和缓解后治疗)的制定。根据遗传学特点可以将AML分为预后相差悬殊的不同危险组; 目前关于AML预后分组标准较被接受的主要有NCCN (美国国立癌症综合网)关于AML治疗指南和ELN(欧洲白血病网)指南两种, 两者也不完全相同, 详见表1 和表2。
| 表1 NCCN根据诊断筛查时的遗传学特征AML危险度分组 |
| 表2 ELN成人AML(非急性早幼粒细胞白血病)预后危险度分组 |
目前AML(非急性早幼粒细胞白血病)的诱导缓解治疗仍是以阿糖胞苷和蒽环类药物联合的方案为基础, 高达80%的患者可以达完全缓解(CR); 当然, 这一比例随年龄的增长而下降, 与细胞遗传学和分子学异常也密切相关。尽管如此, 年轻成年人AML的5年总生存率为35%~40%(部分报道略高), 也就是说绝大多数患者最终还是复发, 多数复发为第一次缓解期12~18个月内复发(这些患者的预后很差)。因此, 预防复发也就成了提高总体生存的关键。为预防复发, 首先要做的是达到第一次CR后应进行缓解后治疗, 缓解后治疗包括标准的强化疗、自体或异基因干细胞移植等。
各种治疗方式的选择强调根据治疗前预后危险度分组和缓解后的微小残留病监测结果来决定。allo-HSCT是抗白血病作用最强的缓解后治疗选择, 也是目前认为可根治AML的手段; 但是生存获益常常被较高的治疗相关死亡率掩盖, 并非所有的AML患者均可以从allo-HSCT中获益、都适合选择allo-HSCT作为缓解后治疗的手段。欧洲白血病网AML工作组强调CR1期的年轻AML选择异基因干细胞移植应进行风险-获益的综合评估:(1)强化疗和allo-HSCT复发的风险; (2)异基因干细胞移植后治疗相关死亡; (3)患者和移植特别要考虑的参数, 尤其是造血干细胞移植合并症指(HCT-CI)和欧洲周血和骨髓移植(EBMT)危险积分所涉及的因素如并发症、供体类型、年龄等。但是到目前为止, 多数关于AML缓解后治疗选择的研究是根据治疗意向分组或实际治疗选择分组比较异基因干细胞移植和化疗的结果, 缺乏设计较严谨、前瞻性的配对比较分析。
本篇文章依据多中心临床研究AMLCG99庞大的数据库(3 989例患者), 给185例60岁以下、在CR1期接受异基因造血干细胞移植的患者(60岁以下、中危组患者接受HLA匹配的同胞供体移植; 60岁以下、高危组接受HLA匹配同胞或无关供体移植)进行配对分析, 主要匹配的标准包括AML类型、细胞遗传学危险度分组、患者年龄、CR1持续的时间等; 次要指标包括性别、随机分配的诱导治疗、达CR的日期等。所分析的两组病例均以非良好细胞遗传学异常为主(良好组占5%, 中等组占73%, 不良组占22%), 每组再根据年龄分为≤ 45岁和46~59岁组进行分析。allo-HSCT组7年OS为58%、传统化疗组为46%(P=0.037); RFS分别为52%和33%(P< 0.001)。亚组分析显示, 细胞遗传学非预后良好组、年龄45岁以上、继发性AML或高危骨髓增生异常综合征患者接受allo-HSCT治疗总生存显著改善; 预后中危和不良细胞遗传学组患者RFS也显著提高。多因素分析显示, 不同年龄组、不同细胞遗传学分组、第一疗程后原始细胞比例不同, 只要接受异基因干细胞移植作为缓解后治疗均可改善总生存。因此, 认为allo-HSCT是最有效的缓解后治疗措施, 45~59岁和/或高危细胞遗传学异常的患者获益更大。鉴于本研究是基于多中心、前瞻性临床研究AMLCG99的数据, 又经过科学的配对分析, 该结论是比较可靠的, 对AML患者(尤其是非预后良好组)缓解后治疗策略的选择有重要的参考价值。
作者也提到本组研究中所采用分子预后标志较少、更详细的亚组分析较困难。初步结果表明:NPM1突变阳性/无FLT3-ITD的正常核型患者无论采用何种缓解后治疗方式, OS和RFS均较好、且无明显差别; 但NPM1野生型和/或FLT3-ITD阳性患者的OS和RFS均较差, 采用allo-HSCT治疗可以改善RFS。
同时注意到, 在≤ 45岁和46~59岁两个年龄段的预后中危组患者接受allo-HSCT治疗的非复发相关死亡(NRM)明显高于传统化疗。这部分患者如果能根据缓解后的微小残留病水平、结合HCT-CI和欧洲周血和骨髓移植(EBMT)危险积分评估区别对待(需要更大的样本量说明问题)有可能进一步降低风险、增加获益。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|