| 刘健, 教授、主任医师、硕士研究生导师, 福建省肿瘤医院乳腺内科行政主任、福建省保健委员会保健专家。中国医师协会乳腺疾病培训专家委员会副主任委员, 国家卫生计生委合理用药专家委员会乳腺肿瘤学组委员兼秘书, 中国临床肿瘤学会、中国老年学会老年肿瘤专业委员会执行委员, 中国临床肿瘤学会抗肿瘤药物安全管理专家委员会、中国抗癌协会乳腺癌专业委员会、中华医学会乳腺学组、中华预防医学会乳腺学组委员, 福建省抗癌协会肿瘤内科治疗专业委员会、乳腺癌专业委员会副主任委员。《医学参考报(乳腺频道)》常务编委, 《欧洲肿瘤年鉴(乳腺癌)》、《中华内分泌外科杂志》、《中华肿瘤防治杂志》、《临床肿瘤学杂志》、《肿瘤学杂志》、《中国肿瘤》编委。刘健教授还担任福建省政协常委, 中国民主促进会福建省委员会副主委、福建省红十字会重特大疾病救助基金监督委员会副主任。 |
Francis PA, Regan MM, Fleming GF, et al. Adjuvant ovarian suppression in premenopausal breast cancer[J]. N Engl J Med, 2015, 372(5):436-446.
1b。
在绝经前、激素受体阳性的早期乳腺癌患者中, 抑制其卵巢功能可显著降低复发率。然而其与他莫昔芬(Tamoxifen, TAM)联用的效果尚不确切。
探讨TAM同期联用卵巢抑制剂对绝经前乳腺癌患者的预后。
• 研究条件:全球多中心研究。
• 研究起止时间:2003年12月至2011年1月。
• 研究方法:优效性、Ⅲ 期、多中心前瞻性随机对照临床试验。
• 研究对象:绝经前激素受体阳性(≥ 10%)、接受根治性手术治疗且完成必要的辅助放化疗患者。
• 干预措施:本研究入组未绝经患者共3 066名, 将其随机分为三组, 分别接受TAM单药、TAM联合卵巢抑制剂或依西美坦联合卵巢抑制剂治疗。
• 评价指标:主要观察终点指标为无病生存期, 次要观察终点指标包括总生存期、无乳腺癌间期等。
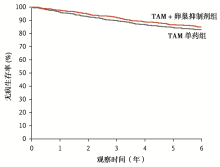
本研究中位随访时间约67个月, 总体5年无病生存率为86.6%, 其中TAM单药组为84.7%[95%可信区间(confidence interval, CI)为82.2%~86.9%], 而TAM联用卵巢抑制剂组为86.6% (95%CI为84.2%~88.7%), 两者无显著差异(复发、第二原发浸润癌或死亡事件的风险比为0.83, 95%CI为0.66~1.04, P=0.1), 见图1。多因素回归分析提示, TAM联合卵巢抑制剂后, 可获得比单药更好的疗效(风险比0.78, 95%CI 0.62~0.98)。早期患者复发率低, TAM单药组5年无瘤生存率为78.0%, 联合卵巢抑制剂后, 5年无瘤生存率可达82.5%(复发风险比0.78, 95%CI 0.60~1.02); 而依西美坦联合卵巢抑制剂后, 患者无瘤生存率为85.7%(与TAM单药相比, 复发的风险比为0.65, 95%CI 0.49~0.87)。
对于整体研究人群, TAM联用卵巢抑制剂并不能带来显著的生存获益。然而, 复发风险高(即需接受辅助化疗且仍未绝经)的患者, 抗激素治疗联用卵巢抑制剂可以改善疾病的预后。与卵巢功能抑制剂联用的治疗方案, 依西美坦效果优于TAM。
绝经前激素受体(hormone receptor, HR)阳性乳腺癌的辅助内分泌治疗是近年的热点问题。美国小于50岁乳腺癌患者约占患者总数的21%, 小于40岁约占4.7%, 而我国绝经前乳腺癌患者比例显著高于美国, 年轻患者更多。因此, 讨论绝经前患者辅助内分泌治疗的意义重大。目前, 绝经前HR阳性乳腺癌的标准辅助内分泌治疗为至少TAM 5年或更长。多项研究评价了早期激素受体阳性的乳腺癌患者, 卵巢抑制治疗单独与联合激素治疗比较, 结局显示改善情况相当于或优于传统化疗方案。迄今为止, 尽管一项绝经前转移性乳腺癌患者的治疗试验发现, 卵巢抑制剂与TAM联合治疗的无病生存期和总生存期优于各自单独治疗, 但由于临床证据的相对不足, 绝经前HR阳性早期乳腺癌辅助内分泌治疗有两大问题一直受到关注:一是卵巢功能抑制(ovarian function inhibition, OFS)前提下, 芳香化酶抑制剂(aromatase inhibitors, AI)可否比TAM辅助治疗有更大的获益?二是绝经前使用TAM的基础上加用OFS是否有进一步的获益?为此, SOFT 和TEXT两项研究的主要分析结果将为绝经前HR阳性的早期乳腺癌辅助内分泌治疗策略提供新的选择。
2014年美国临床肿瘤学会(ASCO)会议上, TEXT、SOFT联合分析告诉我们:对于绝经前HR阳性乳腺癌, OFS+AI优于OFS+TAM, 但两组与TAM单用相比的结果仍待证实。圣安东尼奥时间2014年12月11日, SOFT研究公布了中位随访5.6年的结果, 各组之间无病生存率差异无统计学意义。但亚组分析显示, 对于35岁以下HR阳性乳腺癌患者, OFS+AI治疗5年或TAM治疗5年的无乳腺癌间期显著优于TAM治疗5年。为了将这些数据应用于临床实践, 需要结合当前临床背景。
尽管SOFT 、TEXT两项研究的主要终点指标是无病生存率, 但辅助治疗的终极目标是降低乳腺癌远处复发。依西美坦和TAM的无远处复发时间间隔的差别为 1.8 个百分点。在没有接受化疗的患者中, 远处复发较少, 并且 SOFT 和TEXT研究中的依西美坦治疗组和TAM治疗组间无明显差别。然而, 57.4% 接受化疗的患者中, 依西美坦的无远处复发间隔时间有临床改善, 在 TEXT研究中绝对改善率为 2.6%, 在 SOFT 试验中绝对改善率是 3.4%。SOFT 和 TEXT 研究中无远处复发时间间隔是令人鼓舞的, 尽管 14.8% 的患者出现了淋巴结阳性转移。接受化疗的患者的获益可能是由于在高风险肿瘤中, 芳香化酶抑制剂的应用超出TAM治疗的获益差别, 或者是化疗后芳香化酶抑制剂带来的卵巢抑制的治疗获益。
澳大利亚乳腺和结肠癌症研究组-12 试验(ABCSG-12)也比较研究了卵巢抑制治疗联合TAM或芳香化酶抑制剂, 该研究还探究了双磷酸盐唑来膦酸的应用效果。该试验未发现芳香化酶抑制剂可以带来获益或者肥胖患者结局更差, 这可能是由于卵巢抑制治疗不足所致。这一相反的结果可能是源于以下几个因素:ASCSG-12 试验中只有 5% 的患者接受了化疗, 该试验纳入患者数量少于 TEXT 和 SOFT 试验, 治疗时间只持续了 3 年, 双磷酸盐唑来膦酸的应用可能削弱了芳香化酶抑制剂的效果等。
TEXT 和 SOFT 研究中严重的副反应和生活质量相当。然而, 和TAM相比, 芳香化酶抑制剂的应用导致了更多的性功能障碍、骨质疏松症、骨折和肌肉骨骼症状, 这相比于TAM引起的潮热更为有害, 并且目前评估心血管事件为时尚早。值得注意的是, 两个治疗组中都有 50% 的患者称出现抑郁。
我们如何将这些数据应用于临床实践呢?我们看到SOFT研究最初设计时, 样本量和5年无病生存率都是依据35岁左右患者来进行设定的。但在实际入组的患者中, 有很多35岁以上甚至45岁以上的患者, 而≤ 35岁患者只占10%左右, 严重影响了预计出现的事件数和治疗获益。但是在SOFT研究中, 依据患者是否接受化疗进行分层分析, 对于不需要接受化疗的复发风险比较低的患者, 加入卵巢功能抑制剂并没有改善患者生存, 提示对于40岁以上复发风险比较低的患者, 5年或者5年以上TAM可能仍是标准治疗方法。SOFT研究结果并没有动摇绝经前HR阳性乳腺癌TAM辅助治疗的地位, 但对于40岁以下尤其35岁以下复发风险比较高的年轻乳腺癌患者可以考虑加用卵巢功能抑制提供了选择依据。那么如果这些患者接受化疗后仍然没有绝经的话, 加用卵巢功能抑制剂是能够获益的, 5年的绝对获益是7.7%, 这是一个非常了不起的数字。另外, 在临床实践中不能忽略OFS+AI的明显副作用, 包括绝经后、骨关节、心理问题等等, 要衡量获益和副作用的比例进行个体化选择。对于大于40岁、腋窝淋巴结阴性、肿瘤小、分级低、HER2阴性的绝经前HR阳性乳腺癌患者, TAM 5年仍然是合适的选择; 对于年龄小于40岁, 肿瘤大、分级低、或肿瘤小但高风险的患者则需要个体化分析, 选择合理的治疗方案。对于所有的治疗, 首先要准确地个体化评估其对每位患者带来的利弊。这两项研究的随访时间还比较短, 还有 50% 的复发事件可能会发生, 并且总生存率无显著差别。尤其是未接受化疗的患者组, 出现事件数目较少且卵巢抑制治疗带来的获益尚不清楚。
综上, 目前的结果尚不能改变临床实践, 进一步随访结果的公布或许能提供更多的指导信息。在进一步的结论产生前, 对于激素受体阳性的绝经前早期乳腺癌辅助内分泌治疗还是以TAM为标准。对于接受化疗的绝经前高风险乳腺癌患者, 5 年的卵巢抑制剂联合依西美坦治疗是一项新的治疗选择, 可能会降低远处复发的风险。
The authors have declared that no competing interests exist.