作者简介:温灵珠(1989-),女,广东梅州人,硕士研究生,从事乳腺肿瘤学研究。
目的 分析[18F]-FDG PET对新辅助化疗后不同亚型乳腺癌达到病理完全缓解的预测能力。方法 回顾性分析广东省人民医院经穿刺活检确诊乳腺癌接受新辅助化疗后行根治性手术患者的资料,患者在新辅助化疗前后各行一次[18F]-FDG PET检查,根治性手术后评价是否达到病理完全缓解。计算乳腺肿瘤及腋窝淋巴结的最大标准摄取值变化率,应用受试者工作特征曲线评估最大标准摄取值的变化率预测病理完全缓解的能力。结果 共入组87例患者,Luminal A型、Luminal B(HER2-)型、Luminal B(HER2+)型、HER2阳性型、三阴型患者分别12例、27例、16例、16例、16例。30例(34.5%)术后评价为病理完全缓解,术前[18F]-FDG PET评价36例(41.4%)达到病理完全缓解,最大标准摄取值变化率的曲线下面积为0.802 (95%可信区间0.680~0.893, P<0.000 1),敏感度为61.90%,特异度为87.50%。其中Luminal B(HER2-)型患者曲线下面积为0.907(95%可信区间0.750~1.000, P=0.037)。进一步分析发现,术前[18F]-FDG PET考虑腋窝淋巴结转移的41例患者中,最大标准摄取值变化率的曲线下面积为0.782(95%可信区间 0.625~0.895, P=0.000 1),敏感度为83.33%(95%可信区间51.6%~97.9%),特异度为68.97%(95%可信区间49.2%~84.7%)。但标准摄取值的变化对其他亚型及阴性淋巴结的预测能力较弱。结论 新辅助化疗前后[18F]-FDG PET中标准摄取值对达到病理完全缓解的Luminal B(HER2-)型的乳腺癌及有腋窝淋巴结转移的患者有较好的预测能力。
Objective This study aimed to assess the value of [18F]-FDG PET in predicting pathological complete response (pCR) of breast cancer patients who underwent neoajuvant chemotherapy (NAC).Methods Breast cancer patients diagnosed by core needle biopsy, who underHwent NAC subsequently, with [18F]-FDG PET scanning both before starting after the completing of NAC, were retrospectively enrolled. Definitive surgery was performed for all patients with pCR status evaluated. Relative changes in maximum standardized uptake value (ΔSUVmax%) of breast tumor and axillary lymph node (ALN, if any) were calculated. Receiver operating characteristic (ROC) curves were used to assess the pCR predicting ability of ΔSUVmax%.Results In total, 87 patients were enrolled with the mean age of 46 years. pCR was noted in 30 (34.5%) patients by postoperative pathological examination. Thirty-six (41.4%)patients were categorized as CR by PET scanning before definitive surgery. The area under the ROC curve (AUC) of ΔSUVmax% was 0.802 (95%CI 0.680~0.893, P<0.000 1), with the sensitivity of 61.90%, specificity of 87.50%. For the Luminal B(HER2-) subtype, the AUC was 0.907(95%CI 0.750~1.000, P=0.037). We further found that, in the 41 patients diagnosed to have positive axillary lymph node (ALN) metastasis by pre-therapy PET/CT scanning, ΔSUVmax% also did very well in predicting the clearance of ALN metastasis, which AUC was 0.782(95%CI 0.625~0.895, P=0.000 1) with the sensitivity of 83.33%(95%CI 51.6%~97.9%) and the specificity of 68.97%(95%CI 49.2%~84.7%). However, the predicting value of SUV changes was insignificant in other subtypes and in those with initially negative ALN.Conclusions Relative SUV change between pre-NAC and post-NAC [18F]-FDG PET scanning is able to predict pCR in Luminal B (HER2-) subtype breast cancer, as well as clearance of ALN metastasis in patients with initially positive ALN.
新辅助化疗(neoadjuvant chemotherapy, NAC)能降低乳腺癌患者的临床分期, 检测患者对化疗药物的敏感性, 并能提高患者的病理完全缓解率(pathologic complete response, pCR)[1]。有临床研究结果证实pCR可作为无病生存期或总生存期的可选择替代终点指标, 预测临床远期获益, 对于三阴型及HER2阳性型乳腺癌而言有更好的潜在预测作用[2, 3, 4]。
如何选择合适的影像学方法, 准确有效迅速预测pCR这个终点指标, 为制定个体化治疗方案提供可靠依据极为重要。18氟脱氧葡萄糖正电子发射断层摄影(fluorine-18 fluorodeoxyglucose positron emission tomography, [18F]-FDG PET)以分子水平的代谢变化为显像机制, 通过感兴趣区FDG 的浓聚量、注射剂量及患者体重计算得出标准摄取值(standard uptake value, SUV), 反映恶性肿瘤细胞摄取外源性葡萄糖的能力, 从而判断细胞的良恶性。恶性肿瘤细胞在经过NAC后, 原发肿瘤部位SUV值会出现一定程度的下降。Kim等[5]的研究表明, 原发肿瘤的SUV值的变化更能体现肿瘤对NAC的敏感程度。Jung等[6]进行的研究结果显示, NAC达到pCR的患者, NAC后PET/CT检查中SUV值变化更显著。因此, [18F]-FDG PET这种结合了分子生物学、放射化学及核医学仪器的影像学方法通过比较患者NAC前后最大标准摄取值变化率(maximum standard uptake value change rate, △ SUVmax%), 用以预测NAC是否达到pCR有更多的优势[7]。
为了探索[18F]-FDG PET用于早期评价乳腺癌NAC疗效的能力, 我们利用SPSS 20.0软件的受试者工作特征曲线(receiver operating characteristic curve, ROC曲线)模块, 把患者病理评价结果分为pCR与非pCR, 对患者NAC前后[18F]-FDG PET的原发病灶△ SUVmax%作ROC曲线分析, 探索[18F]-FDG PET对NAC后的不同亚型乳腺癌达到pCR的预测能力。
共纳入广东省人民医院肿瘤中心乳腺科2009-07-11至2012-11-13期间87例经穿刺活检确诊乳腺癌并接受NAC后行根治性手术的患者, 中位年龄为46岁。所有患者经穿刺活检确诊病理类型, 于NAC前后各行一次[18F]-FDG PET检查, 完成根治性手术, 标本送病理学检查, 评价是否达到pCR。
记录患者肿瘤的病理类型, 组织学分级, 激素受体情况, HER2基因扩增情况以及Ki67指数, 若在免疫组化检测中肿瘤细胞HER2免疫组化检测结果为++, 则需要进行HER2荧光原位杂交(FISH)进一步明确HER2基因扩增状态。
根据肿瘤细胞ER、PR、HER2、Ki67等标志物情况将乳腺肿瘤分成五种亚型:Luminal A型, Luminal B(HER2-)型, Luminal B(HER2+)型, HER2阳性型, 三阴型。分子亚型的分型标准如下:
(1)Luminal A型:ER和/或PR阳性, HER2阴性, Ki67< 14%;
(2)Luminal B(HER2-)型: ER和/或PR阳性, HER2阴性, Ki67> 16%;
(3)Luminal B(HER2+)型: ER和/或PR阳性, HER2阳性, Ki67不限;
(4)HER2阳性型:ER和PR阴性, HER2阳性, Ki67不限;
(5)三阴型:ER、PR及HER2阴性, Ki67不限。
所有患者均在我院核医学科行[18F]-FDG PET检查。患者禁食4小时以上, 检查前用微量法检测血糖, 然后静注[18F]-FDG。暗光、静息40分钟后, 进行3D PET采集(Biograph16, 120 KeV, 50 mAs)。采集顺序及范围:会阴部→ 颅底(2分钟/床位)+ 头部。深吸气屏气状态下行胸部CT增强(肺窗1 mm及纵隔窗1.5 mm重建)+同机序贯上中腹部(1 mm及5 mm重建)、头部CT扫描(2 mm重建), 要求影像清晰, 对比度好。
病理评价:以pCR为主要评价指标。pCR定义为:在乳腺及腋窝组织内均无包括导管原位癌在内的恶性肿瘤细胞的组织学证据。
[18F]-FDG PET评价:记录NAC前后原发肿瘤行[18F]-FDG PET 所测量的SUV最大值, 计算NAC前后△ SUVmax%。完全缓解(complete response, CR)定义为原发肿瘤SUV最大值降低至本底水平(记为0)。
采用SPSS 20.0软件对研究所得数据进行分析。利用治疗前后原发肿瘤的△ SUVmax%对pCR作ROC曲线分析, 使用Kappa分析对[18F]-FDG PET评价与病理评价作相关性分析, 显著性水平为P< 0.05; 建立多元Logistic回归分析模型。
所有入组的87例患者中, 30例(34.5%)患者术后病理评价为pCR, 其中, Luminal A型、Luminal B型、HER2阳性型及三阴型患者的pCR率分别为16.7%(2/12)、25%(11/44)、56.2%(9/16)及53.3%(8/15)。
根据对化疗前后PET/CT检查的评价结果, 把患者[18F]-FDG PET评价结果分为CR与非CR, 在所有患者完成NAC后, 36例(41.4%)患者达到了CR, 其中Luminal A型、Luminal B型、HER2阳性型及三阴型患者的CR率分别为41.7%(5/12)、40.9%(18/44)、31.2%(5/16)及53.3%(8/15)。
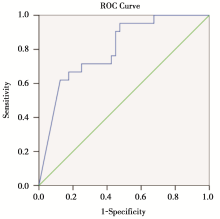
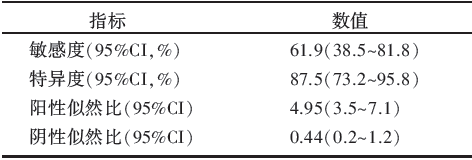
利用SPSS 20.0软件的ROC曲线模块, 对患者NAC前后[18F]-FDG PET检查的原发病灶的△ SUVmax%作ROC曲线分析(见图1), 结果曲线下面积为0.802[95%可信区间(confidence interval, CI)0.680~0.893, 标准误0.067, P< 0.000 1], 当下降率的截断值取> 90%时, 判断患者NAC后能否达到pCR的特异度为87.50%, 敏感度为61.90%(见表 2)。
| 表2 截断值取> 90%时[18F]-FDG PET总体评价能力 |
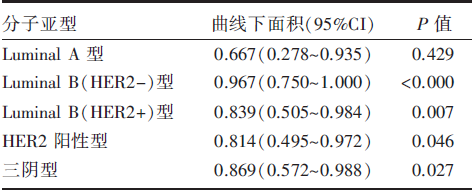
将本研究中的患者根据分子亚型分成亚组, 每个亚组患者分别再用ROC曲线进行分析, ROC曲线下面积对[18F]-FDG PET对各个亚组的评价能力进行对比(见表3), 结果显示Luminal B(HER2-)型乳腺癌的曲线下面积达到0.907(95%CI 0.750~1.000, P=0.037); 三阴型次之, 曲线下面积为0.869, Luminal B(HER2+)型、HER2阳性型及Luminal A型的曲线下面积分别为0.839、0.814及0.667。
| 表3 按照分子亚型分层后各亚型曲线下面积 |
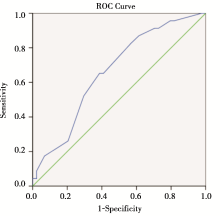
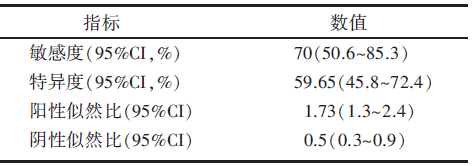
Ki67指数是乳腺癌分子分型的标准之一, 可用于判断细胞的增值活性。Ki67对乳腺病理评价为pCR的ROC曲线下面积为0.682(95%CI 0.574~0.778, P=0.001 7), 有统计学意义。由于[18F]-FDG PET对不同分子亚型的乳腺癌NAC疗效的评价能力不尽相同, 在[18F]-FDG PET预测能力最低的Luminal A亚型中, Ki67指数低; 而在预测能力最佳的Luminal B亚型中, 原发肿瘤往往有着较高的Ki67指数。我们用所有患者的Ki67指数对[18F]-FDG PET完全缓解作ROC曲线分析(见图2), 确定为当原发肿瘤Ki67> 35%时, [18F]-FDG PET对化疗疗效的预测价值最佳, 对pCR的预测敏感度为70.00%, 特异度为59.65%(见表4)。
| 表4 Ki67截断值取35%时预测pCR的敏感度及特异度 |
将原发肿瘤Ki67与NAC前后△ SUVmax%作为自变量, 将是否达到pCR作为因变量进行多因素Logistic回归分析, 结果显示乳腺SUV变化率有统计学意义, 而ki67无统计学意义, 模型拟合优度较好(hosmer and lemeshow test, Chi-square=9.833, P=0.198 ), 尚不能认为Ki67为独立风险因素。
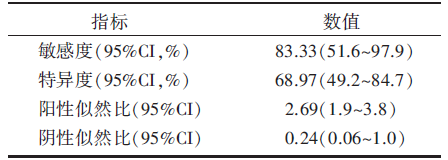
在早期诊断的乳腺癌患者中, 同侧腋窝淋巴结是最常见的转移部位。本研究评价了[18F]-FDG PET对NAC后腋窝淋巴结情况的评估能力。利用NAC后[18F]-FDG PET检查中是否检测到腋窝淋巴结的SUV值增高对术后腋窝淋巴结的病理评价作ROC曲线分析, 所得曲线下面积为0.782(95%CI 0.625~0.895, 标准误0.068, P=0.000 1)。然而我们再用Kappa系数对其进行分析时, 确定腋窝△ SUVmax%的诊断界点为> 95%, PET/CT对腋窝淋巴结的预测价值最佳, 敏感度为83.33%, 特异度为68.97%(见表5), 所得Kappa值为0.409(标准误0.098, P=0.004), 虽然结果有统计学意义, 但说明两者的一致性并不强。
| 表5 腋窝SUV变化率 > 95%的诊断学评价 |
本研究结果显示, 所有87例患者中, 30例(34.5%)患者术后病理评价为pCR, 与此相应, 在患者完成NAC后进行手术治疗前的[18F]-FDG PET评价中, 36例(41.4%)患者 [18F]-FDG PET评价达到CR。在初步统计学分析中, 我们选用了NAC前后△ SUVmax%作为评价指标, 以手术后病理评价作为金标准, 两者之间作ROC曲线分析, 所得的曲线下面积为0.802, 提示[18F]-FDG PET对基于分子亚型的乳腺癌NAC疗效的总体评价能力具有临床应用价值。同时确定了在[18F]-FDG PET评价中化疗前后原发肿瘤SUV值改变的一个自定义截断值为90.7%, 这意味着在临床工作中, 若一名乳腺癌患者在经过了NAC后, 在[18F]-FDG PET评价中其原发肿瘤的SUV值与化疗前相比降低大于90.7%时, 可以认为该患者对目前的化疗方案敏感, 并很可能通过该方案NAC能获得pCR。
由于不同亚型的乳腺癌的生物学行为也不同, [18F]-FDG PET对不同亚型乳腺癌NAC疗效评价能力是否存在差异仍无明确结论。我们同样采用了ROC曲线分析的方法, 以pCR为金标准, 对各个分子亚型进行亚组分析。结果显示Luminal B(HER2-)型、三阴型、Luminal B(HER2+)型、HER2阳性型及Luminal A型的曲线下面积分别为0.907、0.869、0.839、0.814及0.667。结合统计学意义, Luminal B型和HER2型两组患者的曲线下面积均接近0.9, 表明对于这两种分子亚型的患者, 用[18F]-FDG PET对NAC疗效进行评价是有临床意义的。但Luminal A型患者的曲线下面积无统计学意义(P=0.429)。对此, 我们认为可能的原因如下:Luminal A型患者的样本量相对较小, 偏小的样本量可能会影响ROC曲线分析的准确性, 未能体现出统计学显著性。此外, 基于Luminal A型乳腺癌自身的生物学特性, 虽然预后相对良好, 但对化疗的敏感性不高。近年来所报导的文献中, 常规方案的NAC在Luminal A亚型中的pCR率不足10%(1.5%~8.1%)[8, 9, 10, 11]。对化疗的敏感程度不高, 肿瘤细胞在化疗前后的生物代谢水平的改变则较小。我们的结果显示, 在经过NAC后, 原发肿瘤的△ SUVmax%需达到90.7%以上时, [18F]-FDG PET才能达到最佳的评估疗效的能力。在12例Luminal A型患者中, 5例在NAC后的[18F]-FDG PET评价中达到完全缓解, 但在手术后的病理评价中这5例患者均发现了肿瘤残余, 未达到pCR。而达到pCR的2例患者, 在术前的[18F]-FDG PET评价中仍有检测到原发肿瘤部位有高水平的葡萄糖摄取。这2例患者的△ SUVmax%分别为50%和75%, 均未达到我们此前分析所得的截断值90.7%。基于以上结果, 考虑[18F]-FDG PET用于Luminal A型乳腺癌患者NAC疗效的评价效果不佳。
在不同的乳腺癌亚型的生物学特点背后, Ki67是一个很重要的提示化疗敏感性及预后的独立预测因素。在ROC曲线分析中, 我们得出当Ki67取大于35%的截断值时, [18F]-FDG PET对NAC疗效的评价有临床意义, 对pCR的预测敏感度为70.00%, 特异度为59.65%。这也进一步证实了我们的假设, 即在生物学特点恶性程度更高、增殖能力更强的肿瘤中, [18F]-FDG PET对化疗疗效的预测能力更佳。但在进一步分析中发现, Ki67仅在单因素Logistic分析中显示为[18F]-FDG PET评价能力的独立影响因素, 在多因素回归模型中却无法认为Ki67是独立影响因素。这些结果提示原发肿瘤的Ki67指数也许并不能作为一个有效的提示PET/CT评价能力的指标, 但仍需更多进一步的研究来验证它的作用。
在早期诊断的乳腺癌患者中, 同侧腋窝淋巴结是最常见的转移部位。统计结果显示, 利用NAC后[18F]-FDG PET检查中是否检测到腋窝淋巴结的SUV值增高对术后腋窝淋巴结的病理评价作ROC曲线分析, 所得曲线下面积为0.782, P=0.000 1, 具有统计学意义。然而当确定腋窝△ SUVmax%的诊断界点为> 95%时, [18F]-FDG PET对腋窝淋巴结预测价值的敏感度为83.33%, 特异度为68.97%, 所得Kappa值为0.409(P=0.004), 说明[18F]-FDG PET对腋窝淋巴结的评价结果与病理评价结果的一致性不强, 因此不能以[18F]-FDG PET检查结果阴性作为不行腋窝淋巴结清扫的指征。
在未来的研究中, 我们将对比乳腺核磁共振、超声等常规影像学检查与[18F]-FDG PET对NAC后不同亚型乳腺癌达到pCR的预测能力, 增加用[18F]-FDG PET预测能力的可信度。
张安秦教授
(广东省妇幼保健院)
乳腺癌NAC的疗效评价和pCR的预测一直是研究热点, pCR已经成为一个非常有效的疗效预测指标。文章通过回顾性资料分析, 希望通过NAC前后[18F]-FDG PET的对比, 探讨其与pCR疗效预测的价值, 有一定的临床实用价值。研究发现[18F]-FDG PET对基于分子亚型的乳腺癌NAC疗效的总体评价能力具有临床应用价值。确定了在[18F]-FDG PET评价中化疗前后原发肿瘤SUV值改变的一个自定义截断值为90.7%, 另外本预测指标对于Ki67高的乳腺癌预测更准确, 结论有一定的临床可操作性。由于研究病例数的限制, 无法发现本指标与各亚型乳腺癌间的内在关系, 然而却为进一步开展相关研究提供非常好的方向和理论基础。
本研究属于回顾性资料, 希望今后可以扩大病例数, 深入探讨临床资料中肿块大小和淋巴结状况、NAC方案分类、NAC的疗程等因素对于预测结果的影响, 以更好地指导临床实践。同时研究如果加入与常规影像学评估的对比其可信性可更高。
安胜利教授
(南方医科大学)
该研究通过回顾性分析87例经穿刺活检确诊乳腺癌接受NAC后行根治性手术患者的资料, 主要分析了[18F]-FDG PET对新辅助化疗后不同亚型乳腺癌达到病理完全缓解的预测能力。采用SPSS 20.0软件对研究所得数据进行分析。利用治疗前后原发肿瘤的△ SUVmax%对pCR作ROC曲线分析, 使用kappa值对[18F]-FDG PET评价与病理评价结果作一致性分析, 显著性水平取0.05; 利用Logistic回归进行多因素分析。所用统计分析方法正确。但是除了关于腋窝淋巴结达到pCR评估能力部分同时结合了Kappa分析外, 其他部分只给出了特定界值下的灵敏度和特异度, 使得本研究的主要结论降低了一定的说服力。建议主要结论“ NAC前后[18F]-FDG PET中标准摄取值对达到病理完全缓解的Luminal B(HER2-)型的乳腺癌及有腋窝淋巴结转移的患者有较好的预测能力” 部分也同时报告Kappa值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|