| 刘晓晴,主任医师,教授,博士研究生导师。解放军第307医院全军肿瘤中心肺部肿瘤科。从事肺癌的放疗、化疗及靶向生物综合治疗,肺癌个体化治疗的基础和临床研究。承担国家科技部重大专项、首都医学发展基金、首都临床特色医疗等课题。近5年以通讯作者(第一作者)在国内外专业期刊发表论文80余篇,参编著书8部。 参与国家卫计委 《原发性肺癌诊疗规范》(2015年版)和“中国表皮生长因子受体基因突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南”等制定。 目前担任中国抗癌协会化疗专业委员会委员, 中国抗癌协会临床肿瘤学协作专业委员会小细胞肺癌专家委员会副主任委员, 中国抗癌协会肺癌专业委员会内科学组成员, 中国老年肿瘤专业委员会肺癌分委会常委, 中国药学会抗肿瘤药物专业委员会委员, 中国抗癌协会临床肿瘤专业委员会执委, 中国女医师协会肿瘤学专家委员会常委, 中国抗癌协会临床肿瘤学协作专业委员会肿瘤相关贫血专家委员会、肿瘤生物标志物专家委员会委员, 全军放射肿瘤治疗学专业委员会委员。《临床肿瘤学杂志》、《国际肿瘤学杂志》、《肿瘤研究与临床》、《临床肿瘤学论坛》、《肿瘤医学论坛》、JTO中文版杂志编委。 |
Azuma K, Ota K, Kawahara A, et al. Association of PD-L1 overexpression with activating EGFR mutations in surgically resected non small-cell lung cancer[J]. Ann Oncol, 2014, 25(10):1935-1940.
3a。
• PD-1主要表达于T细胞表面, 可以调节T细胞的活性及增殖。PD-1的配体PD-L1表达于多种肿瘤细胞上。PD-L1与PD-1结合可诱导活化的T细胞凋亡或者疲劳。
• 临床研究表明, 阻断PD-L1与PD-1的相互作用可以增强T细胞的抗肿瘤活性。
• 非小细胞肺癌(non-small cell lung cancer, NSCLC)中PD-L1的表达水平与临床预后的相关性, 目前仍不清楚。
• 通过IHC检测NSCLC PD-L1 的表达情况, PNA LNA PCR-Clamp(peptide nucleic acid-locked nucleic acid polymerase chain reaction clamp)法检测EGFR基因突变状态, 阐述PD-L1表达与EGFR信号通路的关系, 回顾性分析多个临床病理特征与NSCLC预后的相关性。
• 研究条件:由MEXT KAKENHI资助(基金号码24501359)。
• 研究时间:2000-2010年。
• 研究方法:回顾性临床研究。
• 研究对象:2000-2010年期间在久留米大学医院接受手术患者的肿瘤标本及NSCLC细胞系。研究获得久留米大学医院伦理委员会批准。
• 干预措施:研究共纳入164例NSCLC患者, 采用IHC法检测细胞PD-L1表达情况(积分法, 高于30分为高表达), 采用 PNA LNA PCR-Clamp法检测肿瘤EGFR 基因突变状态, 免疫印迹法检测NSCLC细胞系EGFR磷酸化水平, 流式细胞技术检测NSCLC细胞系PD-L1表达水平, 分析PD-L1表达与EGFR磷酸化之间的关系。
• 评价指标:EGFR基因突变状态、PD-L1表达水平、EGFR磷酸化水平、生存期。
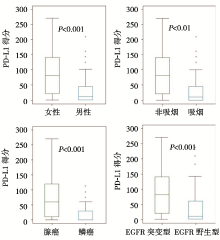
• NSCLC中, PD-L1表达增高与女性、不吸烟、腺癌和EGFR突变显著相关。见图1。EGFR 基因突变(突变型vs. 野生型, 比值比25.4, 95%可信区间2.9~47.9, P=0.027)及腺癌(腺癌vs. 鳞癌, 比值比25.1, 95%可信区间0.5~49.8, P=0.046)是PD-L1高表达的独立因素。
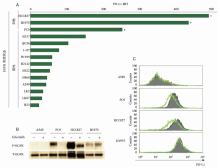
• EGFR 突变的NSCLC中, 通过EGFR信号通路上调PD-L1的表达, 见图2。
• 在EGFR敏感突变同时伴有T790M突变的EGFR-TKI获得性耐药细胞系中, 持续厄洛替尼治疗并不能降低PD-L1 持续的高水平表达。
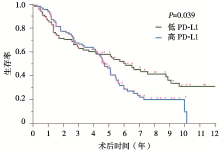
• 生存分析结果提示PD-L1高表达[(高于30分) vs.低表达(低于30分), 风险比1.602, 95%可信区间1.078~2.380, P=0.020]及肿瘤分期为Ⅱ 期或者Ⅲ 期(Ⅰ 期vs. Ⅱ 期或者Ⅲ 期, 风险比0.463, 95%可信区间0.309~0.695, P< 0.001)为独立的不良预后因素, 见图3。
经手术切除的NSCLC, PD-L1的高表达与EGFR基因突变相关, PD-L1高表达是独立的预后不良因素。
近年随着针对免疫检测点CTLA-4和PD-1/PD-L1抑制剂在肿瘤治疗中的应用, 学者们围绕PD-L1进行了诸多探索性研究, 虽然结果不尽如意但却亦有称道之处, 此为理想中的个体化或精准免疫治疗奠定了基础, 并提供了有益启示。
2014年发表于Annals of Oncology的该项研究, 是较早在NSCLC中进行PD-L1表达与预后和EGFR突变关系进行分析的研究之一。研究者采用免疫组化法分析了手术切除NSCLC 164例标本中PD-L1的表达情况, 同时用流式细胞术对NSCLC细胞系中PD-L1细胞表面表达进行定量。结果显示, 肿瘤标本中PD-L1表达在女性、不吸烟和腺癌患者中较高。多因素分析发现, EGFR突变以及腺癌与较高的PD-L1表达显著相关。NSCLC细胞系中, EGFR基因突变细胞表面PD-L1表达明显高于EGFR野生型。EGFR抑制剂厄洛替尼能下调EGFR基因突变NSCLC细胞系的PD-L1表达; 而对于野生型NSCLC细胞系, 厄洛替尼无此作用, 这提示PD-L1表达增加是通过EGFR信号通路, 而EGFR信号通路则是由激活EGFR基因突变所介导。另外对于NSCLC患者, 手术切除肿瘤组织中PD-L1表达水平较高者其总生存期明显缩短。
回览近年相关系列研究并与之比较, 该项研究亮点如下:
(1)作为单中心研究纳入标本数较多, PD-L1检测采用了半定量免疫组化法。
(2)同时针对NSCLC患者标本和细胞系进行了研究, 临床结果与之同时在细胞系研究中给出了合理的解释和验证, 得到了非常有意义的结果。
该项研究结果的启示及意义:
(1)结果一, 肿瘤标本中PD-L1表达增高与女性、不吸烟者、腺癌和EGFR突变患者显著相关。此结果显示了PD-L1与患者临床病理和分子特征的关系, 又可能提示了PD-L1抑制剂治疗的潜在获益人群。
(2)结果二, PD-L1表达的增加是通过EGFR信号通路, 而这种EGFR信号通路是由激活EGFR基因突变介导的。提示PD-L1表达和EGFR突变之间存在相关, 支持抗PD-L1药物联合靶向治疗值得进一步研究(此为PD-L1抑制剂联合针对驱动基因靶向治疗奠定理论依据)。
(3)结果三, 在EGFR敏感突变同时伴有T790M突变的EGFR-TKI获得性耐药细胞系中, 持续厄洛替尼治疗并不能降低PD-L1 持续的高水平表达。提示阻断PD-L1通路有可能是治疗EGFR突变患者TKI获得性耐药的方法。
(4)结果四, NSCLC手术切除肿瘤组织中PD-L1表达水平较高患者总生存期明显缩短。这样一个发现提示我们PD-L1表达是否是独立的预后指标?或对于这样一群不良预后的亚组患者, 针对PD-L1的抑制剂是否需较早期进行干预治疗(术后进行PD-L1抑制剂辅助治疗的理论依据)。
作为较早进行的探索性研究, 基于认识和经验所限, 该研究存在如下不足:
(1)标本问题:研究取得标本来自于近10年间(2000-2010年)手术切除的NSCLC标本, 因时间跨度长, 标本质量受到影响, 另外标本在获取、处理、贮存条件等方面可能有异, 势必影响PD-L1检测结果。
(2)研究为回顾性、单中心, 某种程度上标本量偏小, 这些局限性非利因素对结果均可能产生偏颇。
(3)研究仅分析了PD-L1与EGFR突变的相关性, 未观察与其它高频基因KRAS、ALK等的关系。
(4)因为研究纳入的患者均是手术切除的Ⅰ ~Ⅲ 期NSCLC标本, 该结果是否能代表Ⅳ 期NSCLC中PD-L1表达与临床病理分子特征关系并不明确。另外该研究亦无法评价EGFR突变患者PD-L1表达水平与EGFR-TKI治疗的疗效关系。
近年其它相关研究结果显示:
(1)PD-1和PD-L1的表达依临床和生物学特征而存在差异。PD-L1阳性患者一般为女性、从不吸烟、组织学特征为腺癌、EGFR突变或ALK易位, 而PD-1阳性患者多为男性、吸烟者、组织学特征为腺癌、KRAS突变。但也有研究显示, 在组织学上, PD-L1表达与鳞癌相关。
(2)长期存放的肿瘤组织并不适于检测PD-L1的表达。免疫组化检测PD-L1表达阳性标准的定义不一(阳性细胞比例> 1%、2%、5%或?)。PD-L1/PD-1免疫组化的可信度还需要进一步验证, 目前尚没有任何一种检测方法得到充分验证。
(3)PD-L1在不同肿瘤微环境中的表达存在差异, 且在肿瘤细胞和肿瘤微环境中PD-L1的意义不同, 并且不会在某一时间点停止表达。
(4)肺腺癌PD-L1阳性肿瘤约70%也是MET阳性、KRAS突变或EGFR突变。此外, PD-L1阳性NSCLC还表达其他免疫检查点如TIM3、LAG-3、B7-H3、B7-H4和CTLA-4。这些结果支持抗PD-L1或PD-1药物联合靶向治疗值得进一步研究。
(5)也有研究发现, 在可以手术切除的Ⅰ 期NSCLC(腺癌)患者中, PD-L1过度表达与高级分化和血管侵犯相关, 这些患者无复发生存期较长。PD-L1表达与EGFR、KRAS、BRAF和ALK的表达无关。
(6)在EGFR突变且接受EGFR-TKI治疗的NSCLC患者中, PD-L1阳性患者的疾病进展时间显著长于PD-L1阴性患者。
综合目前的研究结果, 本人认为该项研究所得结论与大部分研究吻合, 值得借鉴, 但需进一步在更广泛人群中进行验证。另外面对目前研究中不确定或似乎矛盾和有异的结论, 未来需要明确如下问题:
(1)尽快标准化或统一PD-L1检测试剂、检测方法(敏感性、特异性)以及不同检测方法阳性判断标准。
(2)大样本、多中心、标准化方法对肿瘤组织的PD-L1表达进行检测, 以明确PD-L1表达的状况与患者临床病理特征、分子标记的关系, PD-L1表达水平与疾病进展和预后的关系(预后指标?)。
(3)设计前瞻性研究, 检测实时新鲜NSCLC标本PD-L1表达情况, 分析表达水平与PD-L1抑制剂疗效的相关性, 明确PD-L1可否作为PD-L1抑制剂治疗的疗效预测指标?
(4)明确免疫状态的动态变化(时间异质性), 如PD-L1表达在疾病不同阶段是否一致?不同治疗方法介入后PD-L1表达是否发生改变?只有这些问题的了然才可能在最恰当的时间给予最合适的免疫靶向治疗。
(5)不同器官和组织的免疫应答存在差异, 所以PD-L1在不同器官、不同组织、甚或同一器官同一组织不同区域中表达是否有差异(空间异质性)?这对于我们预测PD-L1表达与各肿瘤部位疗效至关重要。
(6)除外EGFR突变, PD-L1表达与其它驱动基因(如ALK、KRAS、MET、ROS、RET、BRAF等)和肿瘤免疫因子(如TIM3、LAG-3、B7-H3、B7-H4、OX-40、KIR和CTLA-4等)的关系如何?这些相关关系是PD-L1/PD-1抑制剂与不同靶向和免疫药物联合治疗的理论基础。
总之, 在免疫靶向治疗进入我们视野的短短几年内, 许多研究者敏觉地意识到并身体力行地做了许多有意义的探索性工作, 虽然回头看这些研究设计还欠完美, 结果也尚需进一步验证, 但正是这些点滴和不确定给了我们更多的思考和启示, 鞭策我们在未来研究中视野须高瞻拓宽, 思路要清晰敏感, 工作更待严谨完善。
The authors have declared that no competing interests exist.