| 钟文昭, 胸部肿瘤外科学博士, 副主任医师, 南方医科大学硕士生导师。广东省肺癌研究所副所长, 广东省人民医院肺二科副主任。中国临床肿瘤学会青年委员会肺癌组核心成员, 广东省抗癌协会肺癌专业委员会青委会主任委员, 广东省医学会微创外科学分会胸外科学组委员, 广东省医学会胸外科学分会委员, J Thorac Oncol杂志associate editor。主要研究方向为Ⅲ A期N2肺癌的多学科综合治疗, 肺部孤立结节/肺腺癌/磨砂玻璃样结节的分类诊断和处理, 胸腔镜微创肺癌根治术。主持国家自然科学基金课题2项; 主编《细支气管肺泡癌》和《实用循证医学方法学》, 主译《非小细胞肺癌治疗》, 参编《临床肿瘤学高级教程》、《胸心外科学》。 |
Rizvi NA, Hellmann MD, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230):124-128.
2b。
• 免疫抑制剂能激发自身T细胞反应杀伤癌细胞、增加抗肿瘤治疗疗效, 但其基因水平的分子机制尚不明确。
• 不同肿瘤类型的突变负荷变异较大。
探索非小细胞肺癌(non-small cell lung cancer, NSCLC)突变谱对抗PD-1治疗疗效的影响。
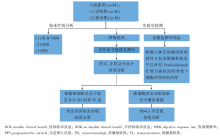
• 研究条件: 美国的Memorial Sloan Kettering Cancer Center (MSKCC)和University of California at Los Angeles(UCLA)参与的NCT01295827研究。
• 研究对象:经筛选进入NCT01295827临床研究的Ⅳ 期NSCLC患者。
• 干预措施:来自MSKCC的29例患者和来自UCLA的5例患者按照NCT01295827研究方案接受Pembrolizumab治疗; 其中5例患者的治疗剂量为2 mg/kg q3w, 29例患者接受剂量为 10 mg/kg q2~3w。
• 研究流程:见图1。
• 评价指标:DCB[部分缓解(partial response, PR)或疾病稳定(stable disease, SD)维持 > 6个月的患者]或NDB(疾病进展或PR/SD维持 < 6个月 的患者); ORR; PFS。
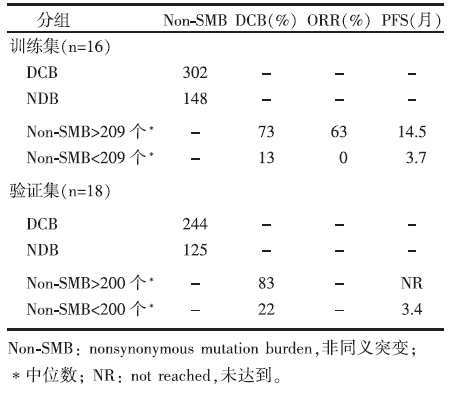
(1)34例患者的非同义突变负荷与Pembrolizumab临床疗效的相关性见表1。
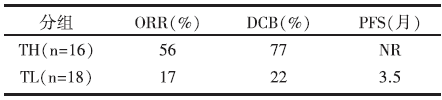
(2)吸烟相关的分子标志(molecular signature of smoking)与Pembrolizumab临床获益的相关性见表2。
(3)DCB患者的癌抗原负荷高于NDB患者; 癌抗原负荷高患者的PFS优于癌抗原负荷低的患者(14.5个月 vs. 3.5 个月)。
| 表1 非同义突变负荷与Pembrolizumab临床疗效的相关性 |
| 表2 吸烟相关的分子标志与Pembrolizumab临床获益的相关性 |
• 非同义突变负荷高的患者, 其客观缓解、长期临床获益和无进展生存均有获益。
• 抗PD-1疗效与吸烟分子特性、高癌抗原负荷及DNA修复通路突变等正相关。
对免疫治疗的探索已历经一个世纪, 然而, 真正唱响舞台的是近两年非常热门的“ 哨卡抑制免疫治疗” 。我们可以看到, 目前哨卡抑制免疫在很多实体瘤中都崭露头角。在NSCLC的二线治疗中, 两个PD-1抑制剂的临床试验都显示出阳性的结果[1, 2]。然而, 试验数据也揭示, 实际上只有20%左右的患者能真正从免疫治疗中获益。现阶段, 寻找有效的生物标志物来预测免疫疗效, 成为临床肿瘤学家新的挑战。
在所有瘤种中, 肺癌的体细胞突变频率非常高[3]。同时, 肺癌本身又是异质性很大的瘤种, 多数非吸烟腺癌可以找到明确的驱动基因, 而吸烟鳞癌则因其体细胞高频突变, 很难找到单一有意义的治疗靶点[4]。既往有研究者提出, 突变负荷高的患者更能从免疫治疗中获益。其假说的理论基础在于, 体细胞突变的肿瘤能产生新的肿瘤抗原继而被免疫细胞识别, 一个高频突变的瘤体内可产生数百种新抗原决定簇, 每一个都可能成为新的靶点。本研究旨在探索肺癌突变谱与免疫疗效的相关性。
该研究设计新颖, 入组34例NSCLC患者, 均接受PD-1抑制剂Pembrolizumab治疗, 并前瞻性分为训练集(n=16)和验证集(n=18)。同时采用全外显子测序, 对其肿瘤组织及正常组织进行配对检测。该研究结果提示, 高的非同义突变量预示着更高的客观缓解率、更持久的临床获益和更长的无进展生存期。此外, 非同义突变负荷较整个外显子区的突变负荷能更好地预测Pembrolizumab的疗效。这也提示我们, 抑制PD-1靶点后, 能刺激抗原特异性T细胞的活性增强, 这为我们今后检测外周血动态监测免疫疗效提供了依据。
另一研究热点PD-L1蛋白表达能否预测PD-1/PD-L1抑制剂的疗效, 目前还没有确定答案。PD-1抑制剂Nivolumab的两个二线临床试验提示我们, 在肺鳞癌和肺腺癌中, PD-L1蛋白预测作用完全不同。Checkmate 057研究提示, 肺腺癌患者中, PD-L1表达是Nivolumab获益的预测因子[2]; 而Checkmate 017则提示, 肺鳞癌患者中, Nivolumab的获益与PD-L1表达无关[1]。在另一项PD-1抑制剂Pembrolizumab的试验中, 纳入NSCLC患者, 其结果提示, ≥ 50%肿瘤细胞有PD-L1表达的患者, Pembrolizumab疗效更优。此外, PD-L1抑制剂Atezolizumab的结果也提示, 无论是肿瘤细胞中还是肿瘤浸润免疫细胞中表达PD-L1均可以预测更好的疗效[5]。对于临床医生, 我们该如何区别看待这般迷离的结果呢?现阶段, 我们还不能轻易地下结论, 而应该探索如何规范PD-L1的检测并合理定义其cut-off值。
那么PD-L1蛋白表达水平与突变负荷之间有无关系呢?该研究入组的34例患者, 30例进行了PD-L1蛋白的IHC检测(clone22C3, Merck), 其中80%(24/30)患者有不同程度的PD-L1表达。该研究在设计时也存在不足, 纳入的大部分患者都有PD-L1表达, 因此, 很难去探索突变负荷与PD-L1表达的关系。探索性分析显示, 高频突变且有PD-L1表达的患者, 其有效率为91%; 低频突变且有PD-L1表达的患者, 其有效率仅为10%。在没有PD-L1表达的患者中, 高频突变者较低频突变者疗效也更佳。今后, 需要更大样本量, 更加规范的PD-L1检测及评价方法来深入探索两者的关系。
正如EGFR突变的发现, 靶向治疗预测因子的探寻之路都异常曲折, 靶向免疫治疗更是如此。肿瘤细胞, 免疫细胞, 各种细胞因子之间交错复杂。今后, 对免疫治疗标志物的探寻, 我们需要同时考虑肿瘤细胞和免疫细胞的生物特性, 可能需要寻找多个标志物, 才能判断哪些患者能从免疫治疗中获益。此外, 在研究设计上, 需要同时选定训练集和验证集。路漫漫其修远兮, 吾将上下而求索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|