| 熊斌, 医学博士, 主任医师, 教授, 博士研究生导师。德国Luebeck医科大学访问学者, 武汉大学中南医院肿瘤外科主任, 武汉大学第二临床学院肿瘤学教研室主任, 武汉大学肿瘤研究所副所长, 湖北省肿瘤临床医学研究中心副主任。中国抗癌协会大肠癌专业委员会常务委员, 中国抗癌协会胃癌专业委员会委员, 中华医学会肿瘤学分会大肠癌学组委员, 湖北省医学会肿瘤学分会副主任委员, 湖北省抗癌协会常务理事, 湖北省抗癌协会胃肠肿瘤专业委员会主任委员, 湖北省抗癌协会肝癌专业委员会副主任委员, 中华医学会武汉分会理事, 中华医学会武汉分会肿瘤学专业委员会副主任委员, 中华临床医师杂志(电子版)、中华结直肠疾病(电子)杂志、实用肿瘤杂志编委。 主要从事胃肠道肿瘤的早期诊断、综合和手术治疗, 恶性肿瘤转移机制及其防治研究。主持国家自然科学基金面上项目1项, 省部级课题7项, 主持和参与国家“ 863计划” 课题2项。发表论文70余篇, 作为副主编出版专著2部, 参编专著2部, 获湖北省科技进步奖二等奖1项, 湖北省自然科学奖二等奖1项。 |
Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency [J]. N Engl J Med, 2015, 372(26):2509-2520.
4。
• 针对程序性细胞死亡1(programmed cell death 1, PD-1)信号通路的免疫治疗在多种肿瘤中取得显著临床疗效。
• 实体肿瘤发生基因突变可以增强肿瘤细胞的免疫原性而成为免疫攻击的靶点。
• 肿瘤细胞内基因错配修复缺陷(mismatch-repair deficiency, dMMR)可以显著增加实体瘤发生突变的机会, 然而肿瘤中存在dMMR是否可以提高抗PD-1免疫治疗临床疗效目前尚不知。
• 比较具有基因dMMR与错配修复完善(mismatch-repair proficiency, pMMR)肿瘤[包括结直肠肿瘤(colorectal cancer, CRC)及非CRC]对于抗PD-1治疗的免疫相关临床疗效的差异。
• 研究条件:病例来源于美国的3个研究中心。
• 研究方法:多中心、Ⅱ 期、非随机对照临床试验。
• 研究时间:2013年9月至2015年1月。
• 研究对象:诊断明确的既往接受治疗进展后的转移性恶性肿瘤(包括CRC及非CRC), 肿瘤组织中MMR状态已知。
• 评价指标:主要终点指标包括免疫相关的客观缓解率(immune-related objective response rate, irORR)及20周免疫相关的无进展生存时间(immune-related progression-free survival, irPFS); 次要终点指标包括总生存时间(overall survival, OS), 免疫相关毒副反应及疾病控制率(disease control rate, DCR)。
• 干预措施:入组患者41人, 其中CRC 32人, 非CRC 9人。分为三组:Cohort A, dMMR CRC, 11人; Cohort B, pMMR CRC, 21人; Cohort C, dMMR非CRC, 9人。三组患者均接受Pembrolizumab静脉给药治疗(10 mg/kg, 每2周给药), 治疗后每8周进行影像学评估疗效。
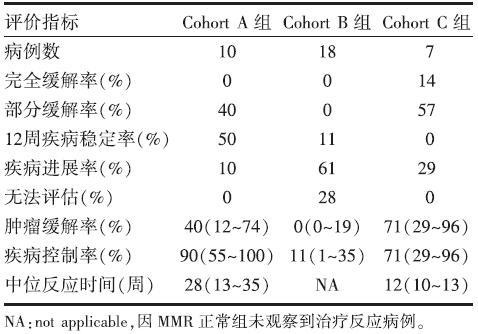
• 三组患者的中位随访时间分别为:Cohort A组36周(5~55周); Cohort B组20周(4~52周); Cohort C组21周(0.1~49周)。三组的主要终点指标为:Cohort A组的irORR为40%(4/10), 95%可信区间(confidence interval, CI)12%~74%, 20周irPFS为78%(7/9), 95%CI 40%~97%。Cohort C组的irORR为71%(5/7), 95%CI 29%~96%, 20周irPFS为67%(4/6), 95%CI 22%~96%。Cohort B组的irORR为0%, 95%CI 0%~20%, 20周irPFS为11%(2/18), 95%CI 2%~18%。按RECIST标准对肿瘤客观缓解评价结果见表1。Cohort A组的DCR为90%(9/10), 95%CI 55%~100%, Cohort C组的DCR为71%(5/7), 95%CI 29%~96%。见表1。Cohort C组与Cohort A组相比具有更快的肿瘤反应时间12周 vs. 28周(P=0.03)。
| 表1 不同分组患者接受抗PD-1治疗肿瘤客观反应率 |
• 三组生存分析结果:Cohort A组中位无进展生存时间(progression-free survival, PFS)及OS均未达到。 Cohort B组的中位PFS仅为2.2个月(95%CI 1.4~2.8个月), 中位OS为5.0个月(95%CI 3.0个月~未评估)。Cohort C组的中位PFS为5.4个月(95%CI 3.0个月~未评估), 中位OS为未达到。post hoc比较dMMR与pMMR结直肠癌显示PFS的风险比(hazard ratios, HR)为0.10, (95%CI 0.03~0.37, P< 0.001); 死亡风险比为0.22, 95%CI 0.05~1.00, P=0.05。
• 全外显子测序显示dMMR中每个肿瘤约平均1 782个体细胞突变, pMMR肿瘤有73个突变(P=0.001 5), 较高的总体细胞突变负荷与PFS具有相关性(P=0.02)。
肿瘤中存在基因dMMR可以显著提高PD-1免疫检测点抑制剂Pembrolizumab的临床疗效。这一结果将进一步指导临床中选择抗PD-1/程序性细胞死亡配体(programmed cell death ligands 1, PD-L1)免疫治疗的优势人群, 为临床肿瘤个体化免疫治疗提供依据。
肿瘤免疫治疗通过激发机体肿瘤免疫体系, 实现恶性肿瘤的治疗效果, 而在众多激活肿瘤免疫体系的手段中, 免疫检查点阻断(immune checkpoints blockage)是目前最具前景的肿瘤免疫治疗方式之一[1]。免疫检查点在生理状态下能提示免疫系统识别“ 自我” , 减少对正常组织的免疫损伤, 而肿瘤组织也能够“ 伪装” 某些免疫检查点, 尤其是肿瘤浸润淋巴细胞 (tumor-infiltrating lymphocytes, TILs)对其抗原的识别, 从而逃避免疫系统攻击。免疫检查点以受体-配体形式激活, 因此针对免疫检查点的肿瘤免疫治疗主要通过阻断其受体配体结合途径, 而目前研究最为广泛的两类为细胞毒T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen 4, CTLA-4)和PD-1[2]。
PD-1的主要功能体现在, 在正常生理过程中限制免疫细胞在正常组织炎症过程中的活性以及抑制自身免疫[3], 目前已知的PD-1功能性配体有PD-L1(B7-H1)和PD-L2(B7-DC), 而PD-1通过与其配体结合, 激活PD-1下游通路从而抑制免疫细胞的免疫活性。PD-L1是PD-1的主要配体, 在多种恶性肿瘤中上调[4], 恶性肿瘤细胞通过表达PD-L1并与PD-1结合, 激活PD-1下游通路, 抑制机体的抗肿瘤作用, 实现肿瘤细胞的免疫逃避。因此阻断PD-1/PD-L1受体配体结合为肿瘤免疫治疗提供了可能。美国食品药品监督管理局(Food and Drug Administration, FDA)认证的Pembrolizumab(MK-3475, KeytrudaTM)以及Nivolumab(MDX-1106, OpdivoTM)就是PD-1特异性单抗(IgG4 mAb), 它们能够特异性结合PD-1而阻断PD-1/PD-L1免疫检查点, 实现肿瘤免疫治疗。
从2006年起, 一系列Ⅰ 期临床试验提示PD-1/PD-L1阻断剂对黑色素瘤、非小细胞肺癌、肾细胞癌[5, 6]、霍奇金淋巴瘤[7]等多种晚期难治性恶性肿瘤有效。继而PD-1/PD-L1阻断剂MK-3475开展了大样本Ⅰ 期临床试验, 该研究提示应用MK-3475治疗晚期黑色素瘤患者, 其缓解率可达到37%~38%, 而且其中还包括了Ipilimumab治疗失败的患者, 这也促成了MK-3475(Pembrolizumab, Merck)在2014年9月通过美国FDA认证。而另一项Ⅲ 期临床试验也对比了Nivolumab与化疗在治疗晚期黑色素瘤患者的效果, 相比化疗Nivolumab能够提高缓解率以及总体生存[8]; Nivolumab针对晚期非小细胞肺癌的治疗, 也优于多西紫杉醇, 能够提高患者的总体生存[9]。PD-1/PD-L1与CTLA-4免疫检查点对于T细胞抑制作用的机制不同, 在临床前试验动物模型联合应用两种阻滞剂能够有效的提高抗肿瘤效果[10], 而且在联合PD-1与CTLA-4免疫检查点阻断剂的Ⅰ 期临床试验表明[11], 联合应用可以提高晚期黑色素瘤患者的缓解率, 为临床联合使用提供了依据。
然而, 免疫检查点阻断并不对所有肿瘤有效, CRC就是其中之一, 无论是Ipilimumab还是Nivolumab、Pembrolizumab的Ⅰ 期临床试验[5, 6, 12, 13], 均表明免疫检查点阻断治疗结直肠癌效果欠佳。在Pembrolizumab的Ⅱ 期临床试验中[14], 作者对比Pembrolizumab在治疗dMMR CRC、pMMR CRC 以及pMMR的非CRC的疗效时, 发现对具有dMMR CRC患者能够从中获益, 这可能是由于dMMR的CRC更易发生微卫星不稳定(microsatellite instability, MSI), 而MSI增加了体细胞突变的概率从而增加了肿瘤细胞的免疫原性[15]。虽然dMMR MSI(+)CRC与pMMR MSI(-) CRC在发病机理上有所不同, 前者更倾向于不断积累体细胞突变增加免疫原性, 但是, 我们还需注意的是, 在细胞层面的一些变化也可能导致基因组不稳定, 从而累积获得体细胞突变增加肿瘤细胞的免疫原性, 例如已有证据表明四倍体能够诱发免疫监视[16, 17], 而并不会导致MSI。而且, 需要我们深入思考的是, 为何免疫检查点阻断治疗对于MSI(-)CRC无效?可能的原因有以下几点:首先, 如果CRC病灶中有丰富的TILs, 效应记忆T细胞占据很大比例, 即使是免疫检查点阻断, 也可能从根本上无法激活此类免疫细胞, 导致治疗无效; 第二, 如果CRC病灶中的TILs数量有限, 虽然能够形成活化的T细胞, 但是很难侵入肿瘤病灶、识别靶细胞、发挥细胞免疫效力, 导致免疫检查点阻断无效; 第三, 生物体是复杂的有机体, CRC细胞携带的抗原, 可能通过非CTLA-4和PD-1/PD-L的其他途径来抑制机体对CRC的免疫监视, 深入研究和发现此类途径能为肿瘤免疫治疗提供新的思路。
Pembrolizumab的Ⅱ 期临床试验为我们治疗晚期CRC提供新的临床数据及潜在的治疗方案, dMMR MSI(+) CRC为临床精准医疗提出新的方向[14]。虽然免疫检查点阻断在临床试验上成功, 为肿瘤免疫治疗带来新的活力, 但是还存在许多尚待解决的问题, PD-1/PD-L1阻断剂针对晚期CRC患者的临床应用, 仍需持谨慎态度。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|