作者简介:王玲和李威为并列第一作者。王玲(1970-),女,广州人,副主任医师,医学博士,主要研究方向为心血管与睡眠呼吸障碍的诊治。李威(1989-),男,广东汕头人,住院医师,在读硕士研究生,主要研究方向为冠心病与周围血管疾病诊治。
目的 探讨经皮冠脉介入术患者使用双联抗血小板治疗后因消化道出血返院诊治的临床特点。方法 选取2011-2013年在广东省人民医院心内科行冠脉介入术长期双联抗血小板治疗后再次住院的患者2 675例,收集了其中28例疑似消化道出血患者的临床资料,对于其中21例确诊为消化道出血的患者使用CRUSADE出血评分系统进行出血风险危险分层,分析该21例患者消化道出血诊治的相关临床特点。结果 21例确诊消化道出血患者中,高龄患者(>60岁)14例(66.7%),男性16例(76.2%),吸烟史患者5例(23.8%),消化性溃疡病史5例(23.8%),消化道出血病史2例(9.5%),肾功能不全病史17例(81%),心功能衰竭病史18例(85.7%),幽门螺杆菌感染7例(33.3%)。使用CRUSADE出血评分系统进行出血风险评分并行危险分层,其中出血风险极高危者7例(33.3%),高危者5例(23.8%),中危者6例(28.6%)。消化道出血前曾预防性口服质子泵抑制剂6例,消化道出血后所有患者均使用质子泵抑制剂治疗。本组患者有一半以上(61.9%)在消化道出血后停用了所有抗血小板治疗药物,消化道出血控制后,约一半(52.4%)患者使用氯吡格雷继续抗血小板治疗。结论 CRUSADE评分系统可以用于经皮冠脉介入术后双联抗血小板治疗患者消化道出血风险的早期评估。抗血小板药物的停用与重新使用应根据消化道出血的严重程度、支架血栓形成的风险等综合评估。
Objective To explore clinical characteristics in patients suffering gastrointestinal bleeding and receiving double anti-platelet therapy (DAPT) after percutaneous coronary intervention.Methods We have screened 2 675 patients hospitalized again receiving dual antiplatelet treatment after percutaneous coronary intervention at Guangdong General Hospital, between 2011 and 2013. Overall, the data from 28 patients with suspected gastrointestinal bleeding were collected. And 21 patients were diagnosed with gastrointestinal bleeding. Baseline risks of major bleeding in these 21 patients were assessed by using CRUSADE bleeding score system and the clinical features were analyzed retrospectively.Results There have been 21 confirmed cases, including 14(66.7%) aged patients (over 60 year age), 16(76.2%) male patients, 5(23.8%) patients with smoking history, 5(23.8%) patients with peptic ulcer history, 2(9.5%) patients with gastrointestinal bleeding history, 17(81%) patients with renal insufficiency history, 18(85.7%) patients with heart failure history, 7(33.3%)patients with Helicobacter pylori infection history. Using CRUSADE bleeding score system to assess baseline risk of major bleeding in these 21 patients, 7(33.3%) cases were at very high risk of major bleeding, 5(23.8%) cases at high risk of major bleeding, and 6(28.6%) cases at moderate risk of major bleeding. Among these patients, there were 6 patients with prophylactic use of proton pump inhibitors (PPIs). PPIs were used in all patients after gastrointestinal bleeding. In this group, more than half (61.9%) were discontinued with all the anti-platelet therapy, and about half (52.4%) were given Clopidogrel only after gastrointestinal bleeding.Conclusion Risk stratification of gastrointestinal bleeding can be made early in patients receiving dual antiplatelet treatment after PCI through using CRUSADE bleeding score system. The use of anti-platelet therapy should be in the light of comprehensive evaluation of the severity of the bleeding and the risk of stent thrombosis once gastrointestinal bleeding occurred.
冠状动脉粥样硬化性心脏病(冠心病)是心血管疾病的首位死亡原因, 早期实施冠状动脉造影和经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)实现血运重建可有效降低其病死率[1]。研究表明, 阿司匹林和氯吡格雷通过不同的途径抑制血小板聚集, PCI 术后联用阿司匹林和氯吡格雷可以降低支架内血栓形成的发生率[2]。2013年, 美国心脏病学会基金会/美国心脏病协会指南明确指出, 对行PCI术后的冠心病患者, 无论使用药物洗脱支架还是金属裸支架, 都建议联用阿司匹林和氯吡格雷[3]。
抗血小板药物是一把“ 双刃剑” , 阿司匹林通过抑制环氧化酶, 一方面抑制血小板活化和血栓形成, 另一方面损伤消化道黏膜, 导致溃疡形成和出血, 严重时可致患者死亡; 其他抗血小板药物如氯吡格雷也能加重消化道损伤, 联合用药时损伤更为严重。双联抗血小板治疗(double anti-platelet therapy, DAPT)能显著降低支架内血栓形成的风险, 由此付出的代价是出血风险增加。有研究表明, 长期服用阿司匹林的患者出现消化道溃疡的发生率为1%~2%[4, 5]; 联合应用阿司匹林和氯吡格雷可使消化道出血的风险增加7~14倍[5, 6, 7, 8]。PCI术后消化道出血, 会增加患者死亡率、住院时间及费用[9]。本文旨在分析DAPT的PCI术后冠心病患者因消化道出血再次返院治疗的临床特点。
本研究筛选了2011-2013年在广东省人民医院行冠脉介入术的患者2 675例, 术后长期DAPT治疗, 28例患者因怀疑消化道出血再次住院治疗, 其中21例经临床及实验室、消化道内镜检查等确诊为消化道出血。
①冠状动脉粥样硬化心脏病行PCI; ②规律服用阿司匹林及波立维DAPT治疗; ③因怀疑消化道出血返院治疗, 结合症状、体征以及实验室检查或消化道内镜检查等确诊为消化道出血。
根据目前指南及专家共识收集患者的资料包括:年龄、性别、消化系统疾病(消化性溃疡史、消化道出血史)、肾病史、糖尿病史、脑血管病史、心功能衰竭病史、其他出血病史、血红蛋白、红细胞压积、肌酐、幽门螺杆菌(helicobacter pylori, Hp)感染、消化道出血症状、心率、血压、消化道出血距PCI时间、抗血小板药物及PPI等药物使用情况等。
根据目前指南及专家共识使用CRUSADE评分系统[10], 进行出血风险评分, 评分指标为入院时的8个基线指标:性别、糖尿病史、既往血管疾病史、心率、收缩压、充血性心力衰竭、基线血细胞比容以及内生肌酐清除率。根据评分结果分为极低危(< 20)、低危(21~30)、中危(31~40)、高危(41~50)、极高危(> 50) 五个级别。
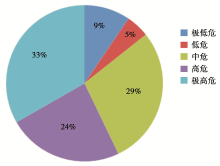
对21例确诊为消化道出血的患者, 根据入院行PCI前的基线资料, 使用CRUSADE评分系统进行出血风险评分。根据评分结果分为极低危(< 20)、低危(21~30)、中危(31~40)、高危(41~50)、极高危(> 50) 5个级别。其中出血风险极高危者7例(33.3%), 高危者5例(23.8%), 中危者6例(28.6%), 低危者1例(4.8%), 极低危者2例(9.5%)。见图1。
21例确诊为消化道出血的患者中, 一半以上(52%)患者出血时间距PCI半年之内。主要临床表现为黑便12例(57.1%), 呕血+黑便4例(19.1%), 便血3例(14.3%), 贫血症状(头晕、乏力、黑朦等)2例(9.5%)。收缩压< 90 mmHg 1例(4.7%), 心率 > 100次/分4例(19.1%)。
21例患者中, 出现消化道出血后血红蛋白浓度90~120 g/L 者7例(33.3%), 60~90 g/L 者12例(57.1%), 30~60 g/L 者2例(9.6%)。血红蛋白较基线水平(入院行PCI前血红蛋白水平)下降 > 50 g/L者9例(42.9%), 下降30~50 g/L者5例(23.8%), 下降< 30 g/L者7例(33.3%)。
21例患者中, 14例患者(66.7%)行消化道内镜检查。确诊为上消化道出血18例(85.7%), 下消化道出血3例(14.3%)。
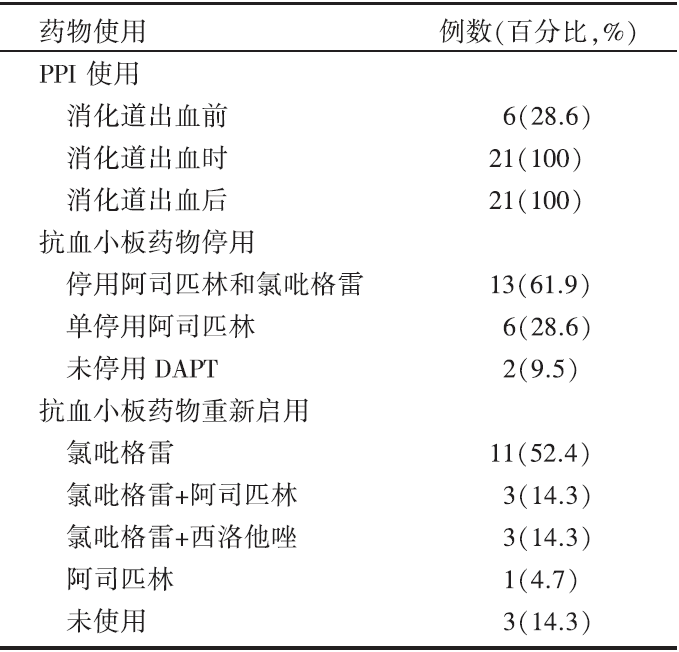
21例确诊为消化道出血的患者中, 消化道出血前有预防性口服PPI者6例(28.6%), 消化道出血时全部患者均使用静脉PPI, 使用时间(7.85± 5.28)天, 消化道出血控制后(无再发呕血、黑便, 生命体征平稳, 红细胞计数、血红蛋白、血细胞比容无进行性下降)均使用口服PPI。出现消化道出血后, 停用阿司匹林和氯吡格雷13例(61.9%), 停用时间(6.38± 4.52)天, 仅停用阿司匹林6例(28.6%), 未停用DAPT 2例(9.5%)。消化道出血控制后, 单用氯吡格雷11例(52.4%), 联用氯吡格雷+阿司匹林3例(14.3%), 联用氯吡格雷+西洛他唑3例(14.3%), 单用阿司匹林1例(4.7%), 未再使用抗血小板药物3例(14.3%)。见表2。
| 表2 药物治疗情况 |
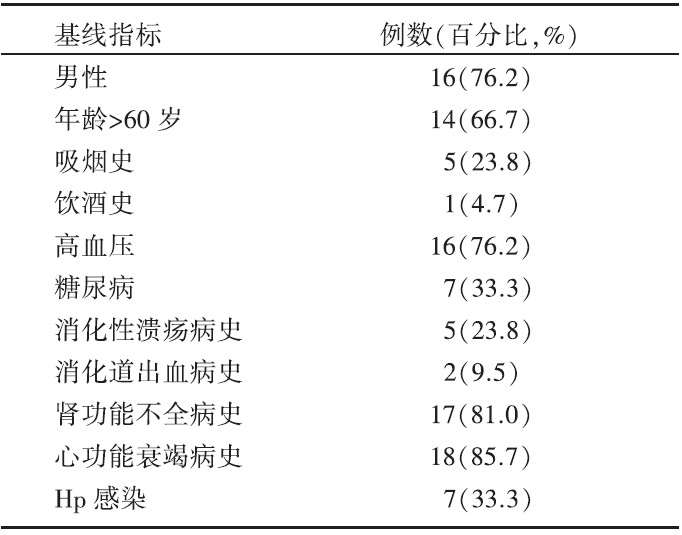
既往已有研究表明, 高龄、吸烟史、饮酒史、消化性溃疡病史、消化道出血病史、联用非甾体抗炎药和抗凝药、肾功能不全、心功能不全、贫血、Hp感染等是PCI术后使用抗血小板引起消化道出血的高危因素[11, 12, 13]。本组患者以老年人居多, 大于60岁者占66.7%, 且大部分为男性(76.2%), 吸烟史患者5例(23.8%), 消化性溃疡病史5例(23.8%), 消化道出血病史2例(9.5%), 肾功能不全病史17例(81%), 心功能衰竭病史18例(85.7%), Hp感染7例(33.3%)。这与既往的研究有相似之处。老年患者是抗血小板药物消化道损伤的高危人群, 年龄越大, 危险越大[14]。低剂量阿司匹林相关的上消化道出血风险随年龄增长而增加(年龄每增加1岁, 消化道出血发生率增加2.3%)[15]。高龄患者易发生出血的一个重要原因是肾功能减退加上药物相互作用, 随着年龄增加, 肝肾功能逐渐衰退, 药效与药物的清除情况都会发生改变, 加上老年人并发疾病较多, 同时服用的其他药物可能与抗栓药物相互作用。因此, 对于PCI术后使用DAPT的患者, 如果合并有上述的消化道出血高危因素, 则更应警惕出现消化道出血可能。
目前, 有许多出血评分系统。例如CRUSADE评分系统, 主要用于评估NSTE-ACS患者发生严重出血的风险, 包括入院时的8个指标(性别、糖尿病史、既往血管疾病史、心率、收缩压、充血性心力衰竭、基线血细胞比容以及内生肌酐清除率)[10]。2013年抗血小板治疗中国专家共识推荐使用CRUSADE出血风险预测模型, 对冠心病患者出血风险进行个体化评估[16]。本组患者, 使用CRUSADE评分系统, 进行出血风险评分并行危险分层, 其中出血风险极高危者7例(33.3%), 高危者5例(23.8%), 中危者6例(28.6%), 中危及中危以上患者占86%, 可见使用CRUSADE评分系统可以有效识别出血高风险患者。在临床实践当中, 应用相应的出血评分系统对患者进行危险程度分层, 可以早期识别消化道出血高危患者, 更好地预防严重出血的发生。
有研究指出, PPI通过竞争性抑制细胞色素P450 CYP2C19同工酶, 减少氯吡格雷在体内转化为其活性成分, 从而降低抗血小板作用[17]。纳入13项研究共48 674例患者的荟萃分析结果显示, PPI与心血管病事件发生和死亡危险增加相关, 但是仅限于高危患者[18]。2009 年美国食品药品监督管理局发布有关氯吡格雷安全性的信息, 指出氯吡格雷与奥美拉唑联用会增加冠心病患者临床不良事件风险。然而, Depta 等和O′ Donoghue 等的研究则表明:尚无足够证据显示DAPT与PPI 联用会增加不良事件的发生风险[19, 20]。现有的临床研究尚不能证实联合PPI增加服用氯吡格雷患者的心血管事件或总体死亡率; 但有证据表明联合PPI可显著降低消化性溃疡的复发率, 尤其降低上消化道出血的发生率[21]。基于上述研究, 很多指南都建议对于那些消化道出血高危的患者, 应联合应用PPI与抗血小板药[22, 23, 24]。本组患者在出现消化道出血前, 仅有6例预防性使用PPI, 在出现消化道出血症状后, 均使用了口服或者静脉PPI, 且使用的PPI大部分为泮托拉唑, 这与现有的一些研究指出的泮托拉唑对氯吡格雷的影响较其他PPI小也是相适应的[22]。本组患者中, 大部分为老年男性, 属于消化道出血高危人群, 而在消化道出血前预防性使用PPI者较少, 仅6例, 这也是造成该组患者出现消化道出血的一个重要因素。根据现有指南, 对于高危患者, 预防性使用PPI能很大程度上减少消化道出血事件的发生。
一旦证实有消化道出血, 第一步是考虑是否停用抗血小板药, 其次是停用的时间。在本组患者中, 有一半以上患者(61.9%)在出现消化道出血症状后停用了所有抗血小板药物, 仅有2例患者未停用DAPT治疗, 停用抗血小板药物取决于出血的严重程度、支架血栓形成的风险与支架置入后多长时间发生的出血等因素的评估。根据抗血小板药物消化道损伤的预防和治疗中国专家共识[24], 如患者发生活动性出血, 常需停用抗血小板药物直到出血情况稳定。但某些患者因停用抗血小板药物会增加血栓事件风险, 尤其是急性冠脉综合征、植入裸金属支架1个月内、药物涂层支架6个月内的患者, 建议尽量避免完全停用抗血小板药物。患者联合使用多种抗血小板和抗凝药物时, 如果发生出血, 应考虑减少药物种类和剂量。当消化道严重出血威胁生命时, 可能需要停用所有的抗凝和抗血小板药物, 停药3~5天后, 如出血情况稳定, 可重新开始使用阿司匹林或氯吡格雷, 尤其是心血管病高危风险的患者。消化道出血症状控制后, 本组患者中约一半(52.4%)使用氯吡格雷继续抗血小板治疗。
(1)识别消化道出血的高危人群。本研究中, 尽管PCI术后经DAPT发生消化道出血返院治疗的患者人数并不多, 但PCI术后消化道出血, 会增加患者死亡率、住院时间及费用, 因此早期识别消化道出血高危人群尤其重要。既往研究表明, 高龄、吸烟史、饮酒史、消化性溃疡病史、消化道出血病史、联用非甾体抗炎药和抗凝药、肾功能不全、心功能不全、Hp感染等均是PCI术后使用抗血小板引起消化道出血的高危因素。在既往的临床实践中, 并没有常规对患者出血风险进行评估及危险分层。应根据具体情况, 选择适合的出血评分系统, 对患者进行危险分层, 早期识别消化道出血的高危人群。
(2)筛查和根除Hp。对于长期服用抗血小板药物的患者, Hp感染是消化道出血的独立危险因素, 根除Hp可降低溃疡和出血的复发[25, 26]。目前推荐的筛查方法为13C或14C呼气试验、粪Hp抗原检测。检测前需停用抗菌药物及铋剂至少4周, 停用PPI至少7天。建议在长期抗血小板治疗前检测Hp, 阳性者应根除。
(3)对高危人群应用PPI预防消化道出血。目前研究表明, PPI可明显降低服用阿司匹林和(或)氯吡格雷患者所致消化道损伤的发生率。PPI是目前预防抗血小板药物相关消化道损伤的首选药物, 优于H2受体拮抗剂和黏膜保护剂。本组患者中, 在消化道出血前, 预防性使用PPI者较少, 仅6例, 这也是造成该组患者出现消化道出血的一个重要因素。我国抗血小板药物消化道损伤的预防和治疗中国专家共识指出[24], 建议根据患者具体情况, 决定PPI联合应用的时间, 高危患者可在抗血小板药物治疗的前6个月联合使用PPI, 6个月后改为H2受体拮抗剂或间断服用PPI。
结论:PCI术后DAPT的患者消化道出血风险评估用CRUSADE评分系统可以进行早期危险分层。发现消化道出血后可根据出血的严重程度、支架血栓形成的风险等综合评估抗血小板药物的停用与重新使用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|