作者简介: 杨兴缨(1970-),女,兰州人,本科学历,从事药物新剂型和临床应用研究。
通讯作者: 焦海胜,Tel:0931-8942571; E-mail:13919331263@163.com
目的 系统评价西妥昔单抗治疗头颈部进展期鳞癌的有效性和安全性。方法 全面检索PubMed、EMBASE、Cochrane图书馆、OVID、CBM、CNKI、维普和万方数据库,采用Cochrane handbook推荐方法进行质量评价,使用RevMan 5.0进行合并分析。结果 纳入6项研究,共2 061例患者,Meta分析显示西妥昔单抗可显著提高患者的总生存期[风险比0.8, 95%可信区间(0.7,0.92)]和无进展生存期[风险比0.72, 95%可信区间(0.55, 0.94)],同时提高治疗的有效率[相对危险度1.65, 95%可信区间(1.0, 2.73)]和控制率[相对危险度1.44, 95%可信区间(1.06, 1.98)],但增加了一些不良反应如痤疮样皮疹、输液反应、低镁血症、脓毒血症、厌食和黏膜炎的风险。结论 西妥昔单抗可改善头颈部进展期鳞癌患者的总生存期和无进展生存期,提高治疗有效率和疾病控制率,不引起严重的不良反应,此结论仍需大样本、高质量的临床试验进一步支持。
Objective Systematically review the efficacy and safety of Cetuximab for advanced head and neck squamous cell carcinoma (NHSCC).Methods Databases including PubMed, EMBASE, Cochrane Library, OVID, CBM, CNKI, VIP and Wanfang were comprehensively searched. We conducted quality assessment using the method recommended by Cochrane handbook and pooled analysis using RevMan 5.0.ResultSix trials with 2 061 patients were included. Compared with controlment, Cetuximab combined therapy decreased risk of disease progression [HR=0.72, 95%CI (0.55, 0.94)] and death [HR=0.8, 95%CI (0.7, 0.92)], and improved response rate [RR=1.65, 95%CI (1.0, 2.73)] and disease control rate [RR=1.44, 95%CI (1.06,1.98)]. Meanwhile, in terms of safety, significant differences were found in aspects of acne-like rash, infusion reaction, hypomagnesemia, sepsis, anorexia, and mucositis.Condusion Regardless of serious and uncontrollable adverse event, Cetuximab could improve OS, PFS, response rate and disease control of HNSCC patients. While clinical trials with large samples and high quality are still warranted to support this conclusion.
头颈部癌是全世界范围内的第6位的恶性肿瘤, 同时也是引起肿瘤相关性死亡的最常见类型之一[1], 其中90%为鳞状细胞癌, 主要位于口腔、鼻腔, 鼻窦、咽部和喉部[2]。早期患者手术常可以取得较好的效果, 但大约2/3的患者确诊时已处于进展期, 因性别、年龄和健康状况的影响, 手术不能取得较好的效果, 通常在术前或术后联合以铂类为主的化疗或者放疗[3]。但由于特异性不强、肿瘤的耐药和放化疗毒副反应的存在, 进一步影响了治疗效果。西妥昔单抗(Cetuximab, CET)是作用于表皮生长因子受体(epidermal growth factor receptor, EGFR)的单克隆抗体, 其特异性结合于EGFR后通过抑制细胞内的信号转导, 以及调理免疫细胞介导的吞噬和细胞毒性反应起到抗肿瘤的作用[4]。西妥昔单抗最先用于治疗转移性结直肠癌和非小细胞肺癌, 证明有效[5], 并在2006年被美国食品药品监督管理局批准用于治疗头颈部鳞癌(head and neck squamous cell carcinoma, HNSCC)。随后开展了一系列的临床试验, 但西妥昔单抗联合放化疗是否可以提高临床疗效, 以及其安全性问题, 各研究结果并不一致[6], 鉴于国内相关研究较少, 故本研究荟萃分析了所有相关的随机对照试验, 以期为临床应用西妥昔单抗治疗HNSCC进行有益的探索并获取一定的支持证据。
1.1.1 研究类型 无论是否采用盲法的前瞻性随机对照试验(randomized controlled trials, RCT), 公开发表, 语言限定为中文或者英文。
1.1.2 研究对象 纳入标准:①经病理或细胞学确诊的HNSCC患者; ②包括口咽、下咽、喉、声门、口腔和其他部位的肿瘤; ③年龄、性别和国籍不限。排除标准:①鼻咽癌和食管癌等组织学类型特别的肿瘤; ②血常规和肝肾功能严重异常; ③有放化疗禁忌证或最近3个月接受过抗EGFR治疗者。
1.1.3 干预措施 对照组患者接受以铂类为主的化疗方案或者放疗方案, 而治疗组在对照组治疗方案的基础上联合应用CET, 除CET外, 两组的治疗方案完全相同。
1.1.4 评价指标 总生存期(overall survival, OS), 无进展生存期(progression-free survival, PFS), 有效率(部分缓解+完全缓解), 疾病控制率(部分缓解+完全缓解+疾病稳定), 3/4级不良反应。
计算机检索中文数据库CBM、CNKI、维普和万方, 英文数据库PubMed、EMBASE、Cochrane 图书馆、OVID、美国临床试验注册中心, 以及2000-2014年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)和欧洲肿瘤学会(European Society for Medical Oncology, ESMO)会议论文, 检索时间均限制为数据库建库到2014年11月。中英文检索词分别为:西妥昔单抗、爱必妥、头颈癌、鳞癌和cetuximab、erbitux、IMC-C225、head and neck cancer、squamous cell carcinoma。采用主题词与自由词相结合的方法, 同时追查相关文献中的参考文献。
由2名评价者通过以上的搜索策略和纳入排除标准筛选, 通过阅读题目和摘要纳入可能符合的文献, 是否纳入最终通过阅读全文决定。交叉核对结果, 对有异议的文献通过讨论解决。之后依据设计好的数据提取表, 独立完成包括题目、作者、发表时间、治疗方案、年龄、性别、肿瘤部位基本资料和测量数据。对于文中未报道风险比及可信区间或P值者, 但报道了K-M曲线或者K-M曲线节点数据者采用Tierney所推荐的方法进行计算。
主要依据Cochrane协作网推荐的方法进行, 由2名评价者对包括随机序列的产生方法、分配隐藏、盲法、失访、是否采用意向性分析(intention to treatment, ITT)和选择性报告等方面进行评价。
采用Cochrane协作网提供的RevMan 5.0软件进行数据分析, 效应量采用相对危险度(relative risk, RR)或风险比(hazard ratio, HR)及其95%可信区间(confidence interval, CI)表示。异质性检验采用2检验, 当I2≥ 50%, 在充分考虑临床异质性的基础上, 使用随机效应模型, 否则采用固定效应模型。敏感性分析通过剔除方法学质量较差的研究, 发表偏倚通过倒漏斗图检验。
初检文献1 106篇, 去除重复、阅读题目和摘要后得到12篇, 通过阅读全文后排除未报道关键数据者2篇, 肿瘤部位特殊者2篇, 以及同一研究的不同报道2篇, 最终纳入6项研究[6, 7, 8, 9, 10, 11], 共2 061名患者。
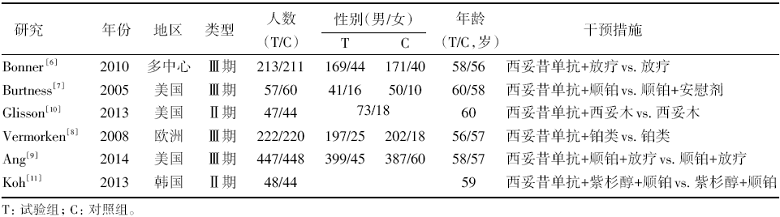
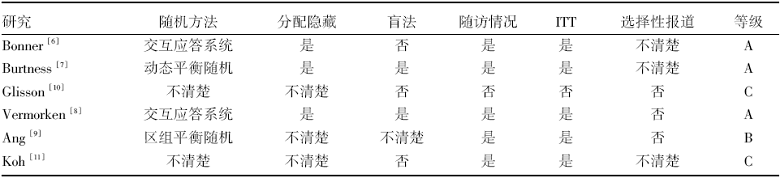
纳入的6项RCT包括2项Ⅱ 期[10, 11]和4项Ⅲ 期[6, 7, 8, 9]临床试验, 共2 061例患者, 其中试验组1 034例, 对照组1 027例, 纳入研究的一般情况见表1, 各项研究的方法学质量评价结果见表2。
| 表1 纳入随机对照研究的一般特征 |
| 表2 纳入随机对照研究的质量评价 |
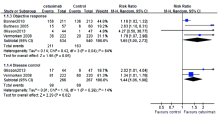
2.3.1 总生存期(OS) 4项研究报告了两组间的调整后的OS的风险比[6, 7, 8, 9], 各研究间无异质性(I2=0%), 故采用固定效应模型, 结果显示西妥昔单抗可以降低进展期头颈部鳞癌的死亡风险, 差异具有统计学意义[HR=0.80, 95%CI (0.70, 0.92), P< 0.01], 见图1。
2.3.2 无进展生存期(PFS) 4项研究报告了两组间的调整后的PFS的风险比[6, 7, 8, 9], 各研究间存在异质性(I2=76%), 故采用随机效应模型, 结果显示西妥昔单抗可以降低疾病进展的风险, 差异具有统计学意义[HR=0.72, 95%CI (0.55, 0.94), P=0.02], 见图2。
2.3.3 有效率/疾病控制率 4项研究报告了有效率[6, 7, 8, 11], 各研究间存在异质性(I2=64%), 采用随机效应模型, 结果显示西妥昔单抗可以提高治疗的有效率, 差异具有统计学意义[RR=1.65, 95%CI(1.0, 2.73), P=0.05]。2项研究报告了疾病控制率[8, 11], 各研究间异质性小(I2= 14%), 结果显示西妥昔单抗可以提高疾病的控制率, 差异有统计学意义[RR=1.44, 95%CI (1.06, 1.98), P=0.02], 见图3。
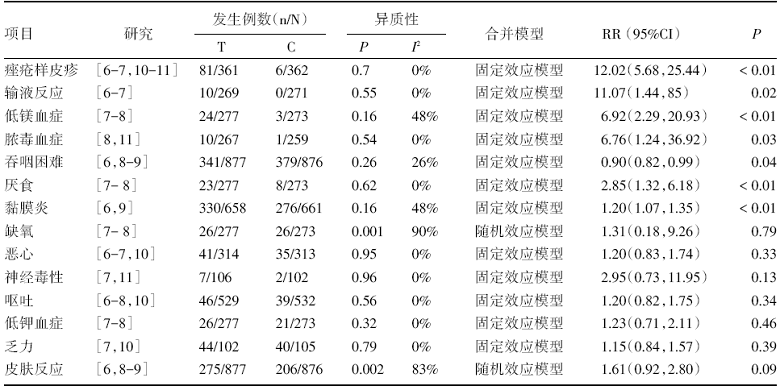
纳入研究中报道了呕吐的共5项, 报道痤疮样皮疹的4项, 报道了低镁血症、吞咽困难、厌食、恶心、低钾血症、乏力和皮肤反应的各有3项研究, 报道输液反应、脓毒血症、黏膜炎、缺氧和神经毒性的各有2项。Meta分析结果显示相比于对照组, 治疗组的痤疮样皮疹、输液反应、低镁血症、脓毒血症、厌食和皮肤反应的风险增高, 同时在总的3/4级不良反应方面, 差异具有统计学意义(P< 0.05), 具体见表3。
| 表3 联合CET治疗头颈部鳞癌的主要不良反应 |
剔除方法学不清楚的会议论文[8, 11]和质量评级相对较差的研究[9]后, 分析结果均未发生明显改变, 分别为无进展生存期[HR=0.64, 95%CI(0.51, 0.79), P< 0.01]和有效率[RR=1.56, 95%CI(0.95, 2.57), P=0.08]。不良反应中鉴于纳入研究的数量, 对痤疮样皮疹、吞咽困难、呕吐和皮肤反应亦进行了敏感性分析, 结果均与之前比较未出现明显不同, 证明其敏感性低, 结果可靠。
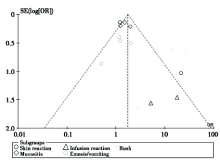
对OS、PFS、OR和3/4级主要并发症的结果行漏斗图检验, 以对可能存在的发表偏倚进行判断。以主要不良反应为例, 显示图形左右基本对称, 呈上窄下宽的倒漏斗形, 表明存在发表偏倚的可能性较小, 见图4。
Meta分析结果显示, 与未使用CET的对照组相比, 联用了CET的治疗组在OS和PFS方面有优势。因为各项研究的随访时间不同, 单纯最终随访时的结果并不能代表整体的生存情况, 类似于之前研究, 本研究亦采取合并各研究中通过Cox回归分析消除不同时间点的影响后得出的HR(即调整HR)来评价OS和PFS, 结果显示联用CET可降低20%的死亡风险和28%的疾病进展风险。同时治疗组在治疗的有效率(RR=1.65)和疾病控制率(RR=1.44)方面亦优于对照组。
在3/4级毒副反应方面, 与对照组相比, 西妥昔单抗联合化疗方案明显增加了输液反应(RR= 11.07), CET为抗EGFR人/鼠嵌合单克隆抗体[4], 作为外源性的大分子抗原进入人体时相对于一般化疗药物更容易引起机体的过敏反应。而CET与肿瘤组织高表达的EGFR结合后, 介导淋巴细胞及细胞因子对肿瘤的杀伤, 从而减少患者因肿瘤生长所致的吞咽困难(RR=0.9)。但同时因EGFR在增生活跃的正常组织中亦广泛表达[12], 当CET结合于正常组织时同样会导致自体细胞的损伤, 引发非特异的炎症反应, 从而增加了试验组的厌食(RR=2.85)的风险, 而这种对正常组织的“ 牵连” , 可能进一步加剧了其他化疗药物(如铂类、氟尿嘧啶类)和放疗所致的机体免疫功能损害, 从而导致脓毒血症的发生风险增加(RR=6.76), 而在其他的非特异的不良反应如呕吐、恶心和乏力等方面无差异。
虽然美国食品药品监督管理局2005年发布了西妥昔单抗可能导致低镁血症的警告, 但具体的机制目前尚不明确。在本研究中同样发现治疗组低镁血症的发生风险是对照组的6.92倍, 低于文献中在非小细胞肺癌(RR=9.28)和结直肠癌(RR=9.5)的发生风险[13], 同时未伴有心血管意外发生风险的增高, 可能与治疗组额外的静脉补充镁治疗有关[14]。同时痤疮样皮疹作为区别于皮肤反应的一类并发症, 其可能在患者的疾病进展和预后方面有重要的预测价值。研究发现皮疹的发生与使用CET的时间和剂量并无明显相关性, 发生中度皮疹的患者相对于未发生或发生中度以下皮疹患者的死亡风险(HR=0.49)明显下降[6]。但同样有研究指出, 因为有化疗药物的联合使用, 所以并不能完全排除以上的不良反应是其他化疗药物的作用或者药物的联合作用所导致, 西妥昔单抗治疗肿瘤的相关机制急切需要基因和分子层面的深入研究[15]。
敏感性分析和发表偏倚检验证实各项结果的稳定性好, 存在发表偏倚的可能性小。但是本研究尚有一定的局限性, 在纳入的研究中有2个研究仅提及使用随机分组、3个研究未提及是否进行分配隐藏, 均可能导致一定的选择偏倚。同时由于CET组有特异的痤疮样皮疹而导致盲法的实施效果受到影响, 从而可能导致一定的实施偏倚和测量偏倚。同时在病例选择和治疗疗程方面, 各研究间亦存在一定的临床异质性。Glisson的研究中, 患者主要为化疗后复发者, 采用负荷剂量的CET联合放化疗, 虽然试验组相对于对照组的疾病控制率(38% vs. 19%)和6个月时的无进展生存率(15.3% vs. 5.9%)增加, 但差异无统计学意义, 故CET在难治性、复发性头颈癌中效果可能仍然非常有限, 同时可能与其纳入的样本量较少、患者因经济负担等问题接受的疗程不同有关。Ang的研究中, 试验组与对照组相比, 在OS(HR=1.05)和PFS(HR=0.87)方面差异均无统计学意义, 试验组有74%的患者接受了CET 6个及以上的疗程, 除与纳入患者的健康状况和支持辅助治疗的差异有关外, 可能与肿瘤的EGFR表达率以及机体的K-ras基因有关。而K-ras基因的突变已被证明在结直肠癌中与患者的治疗效果和预后密切相关[16]。以上各个方面均会对本研究的论证强度产生一定影响。
本荟萃分析显示, 基于目前的证据, CET联合放化疗可改善HNSCC患者的OS和PFS, 提高治疗有效率和疾病控制率, 无严重的不可控的不良反应, 但仍需大样本、高质量的临床试验进一步进行支持。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|