| 刘金来, 中山大学附属第三医院心血管内科教授、主任医师, 心内科副主任, 博士生导师。任中国医师协会中西医结合医师分会心血管病学专家委员会委员、广东省健康管理学会心血管病学分会副主任委员、广东省老年保健协会心血管内科委员会副主任委员、广东省医学会循证医学分会副主任委员、广东省康复医学会心血管病专业委员会副主任委员、广东省医学会心血管病学分会高血压学组成员、广东省心脏起搏及心电生理学会委员、广东省医师协会心血管内科医师分会委员, 广东省医师协会高血压专业医师分会常务委员。《循证医学》、《国际内科学》、《中华老年多器官疾病杂志》等多本杂志编委。主持和参与多项部省级科研课题、主编学术专著4部, 参编5部, 发表学术论文100余篇, 擅长冠心病、高血脂、高血压、心律失常、心力衰竭等心血管疾病的诊治, 以及超声心动图诊断。 |
研究一:Sabatine MS, Giugliano RP, Wiviott SD, et al. Efficacy and safety of Evolocumab in reducing lipids and cardiovascular events [J]. N Engl J Med, 2015, 372(16):1500-1509.
研究二:Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of Alirocumab in reducing lipids and cardiovascular events[J]. N Engl J Med, 2015, 372(16):1489-1499.
1b.
大量研究证实, 降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)可有效减少主要心血管事件。因此, 各大指南一致推荐降LDL-C治疗是减少心血管发病率和死亡率的基石。在过去的3年里, 多项Ⅱ 期及Ⅲ 期临床试验表明, 在标准治疗的基础上, 前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin-kexin type 9, PCSK9)抑制剂短期内(8~12周)能有效减低LDL-C水平达40%~70%。因此, PCSK9抑制剂被认为是一类具有广阔前景的调脂新药而受到全球关注。然而, PCSK9抑制剂降低血脂和减少心血管事件的长期有效性和安全性仍有待进一步评估。鉴于此, OSLER研究和ODYSSEY LONG TERM研究分别对接受PCSK9抑制剂Evolocumab和Alirocumab治疗的患者进行长期随访, 获得了令人振奋的结果。
评估PCSK9抑制剂Alirocumab和Evolocumab降低血脂和减少心血管事件的有效性及安全性。
研究一:OSLER研究
• 研究条件:整合了OSLER-1和OSLER-2研究的资料。其中OSLER-1研究有全球190个中心参与; OSLER-1研究有全球305个中心参与。
• 研究时间:2011年10月至2014年6月、心血管事件分析截止日期为2015年1月21日; 人口学、血脂和安全性资料分析截止日期为2014年10月31日。
• 研究方法:多中心、开放性、前瞻性、随机对照研究。
• 研究对象:OSLER-1的研究对象为前期完成Evolocumab Ⅱ 期临床试验的患者; OSLER-2的研究对象为前期完成Evolocumab Ⅲ 期临床试验的患者。
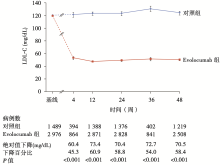
• 干预措施:共入组4 465例患者, 按2∶ 1比例随机分为试验组(n=2 976)和对照组(n=1 489), 试验组接受Evolocumab(140 mg/2周或420 mg/月, 皮下注射)+ 标准治疗, 对照组仅接受标准治疗。
• 评价指标:主要终点指标为不良事件发生率, 次要终点指标为LDL-C水平的变化。预设探索性结局(prespecified exploratory outcome)指标为预设心血管事件的发生率。
研究二:ODYSSEY LONG TERM研究
• 研究条件:全球27个国家的320个中心参与。
• 研究时间:2012-2014年。
• 研究方法:多中心、前瞻性、双盲、随机对照研究。
• 研究对象:成年人(≥ 18岁), 具有杂合子家族性高胆固醇血症, 或明确的冠心病, 或冠心病等危症, 且筛选时LDL-C水平≥ 70 mg/dL(1.8 mmol/L)。上述对象在筛选前均已接受高强度或最大耐受量的他汀类药物治疗, 联合或未联合其他降脂治疗, 且治疗时间不少于4周(非诺贝特至少6周)。这些降脂方案将维持于整个试验过程。
• 干预措施:共入组2 341例患者, 按2∶ 1比例随机分为试验组(n=1 553)和对照组(n=788), 试验组接受Alirocumab(150 mg/2周, 皮下注射), 对照组接受同样剂型的安慰剂。所有患者均接受稳定的治疗性生活方式和按规定饮食。
• 评价指标:主要有效终点指标为第24周LDL-C水平的变化; 次要有效终点指标为整个服药期间LDL-C水平的变化以及第12、24周其他脂蛋白指标的变化。安全性终点指标为第一次注射至最后一次注射后10周内的不良反应事件。复合终点指标为预设主要心血管事件的发生率。
研究一:OSLER研究
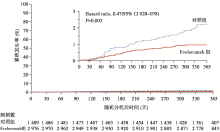
患者特征:中位随访时间11.1个月(四分位距11.0~12.8个月), 总随访4 219.4人年, 平均年龄58岁。80.4%的患者具有最少一项心血管危险因素。70.1%的患者在试验起始时正在接受他汀类药物治疗。7.2%的患者试验期间终止了Evolocumab治疗。
血脂变化:未分组前患者基线LDL-C中位水平为120 mg/dL。随访第12周, 试验组与对照组相比, LDL-C水平下降61%(95%可信区间59%~63%, P< 0.001), 即绝对值下降73 mg/dL, 中位水平达到48 mg/dL, 且降低的LDL-C水平可维持至研究结束。在第12周, 试验组90.2%患者LDL-C水平不超过100 mg/dL, 73.6%患者不超过70 mg/dL; 这两项比例在对照组仅为26.0%和3.8%(见图1)。其他动脉硬化相关血脂指标的变化与LDL-C相似, 试验组非HLD-C下降82.0%, 载脂蛋白B下降47.3%, 总胆固醇下降36.1%, 甘油三酯下降12.6%, 载脂蛋白(a)下降25.5%, 而HDL-C和载脂蛋白A1分别上升7.0%和4.2%(上述所有指标P< 0.001)。
安全性和不良事件:试验组和对照组不良事件发生率分别为69.2%(2 060/2 976)和64.8%(965/1 489), 其中严重不良事件发生率为7.5%(222/2 976 vs. 111/1 489)。两组转氨酶(1.0% vs. 1.2%)和肌酸激酶(0.6% vs. 1.1%)升高的发生率亦相似。尽管神经认知不良事件总体发生率较低(< 1%), 但试验组发生率更高(0.9% vs. 0.3%)。值得注意的是, 神经认知不良事件的发生率与LDL-C水平无相关性.试验组有129例患者(4.3%)出现注射部位反应, 其中6例(0.2%)因此终止了Evolocumab治疗。9例(0.3%)试验组和4例(0.3%)对照组患者检测出新的Evolocumab阻断性抗体; 接受重复检测的患者数据表明这些抗体是短暂存在的。研究未检测到Evolocumab中和性抗体。
心血管事件:与对照组相比, 试验组总心血管事件发生率显著降低(随访1年的Kaplan-Meier分析, 0.95% vs. 2.18%, 风险比0.47, 95%可信区间 0.28~0.78, P=0.003), 两组累积心血管事件发生率曲线随时间逐渐分离(见图2)。主要不良心血管事件分析亦得出相似的结果。
研究二:ODYSSEY LONG TERM研究
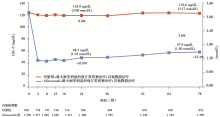
患者特征:患者平均年龄60岁, 其中37.8%为女性, 68.9%有冠心病史, 17.7%有杂合子家族性高胆固醇血症。除2例患者外, 其余患者均全程使用他汀类药物治疗, 其中46.8%接受高强度他汀类药物治疗, 28.1%同时使用其它的降脂药物治疗。患者基线LDL-C水平为122 mg/dL(3.2 mmol/L)。参与有效性分析的2 338例患者(试验组n=1 550, 对照组n=788)平均药物使用时间为70周, 其中试验组Alirocumab总使用量为2 061人年。试验组和对照组评价随访时间分别为80.9周和80.1周, 平均药物使用依从率分别为98.0%和97.6%, 平均药物终止率为28.2%和24.5%。共有98.7%的患者符合意向性治疗分析(intention-to-treat)标准并纳入主要有效性分析。
有效性分析:第24周, 试验组和对照组LDL-C水平分别为48.3 mg/dL(1.25 mmol/L)和118.9 mg/dL(3.08 mmol/L)。其中试验组LDL-C水平较基线下降61.0%, 而对照组较基线上升0.8%, 两组变化相差61.9%(P< 0.001)(图3)。试验组达到LDL-C< 70 mg/dL目标值的患者比例为79.3%, 而对照组仅为8.0%(P< 0.001)。试验组LDL-C降低从第4周一直持续至78周; 但基于意向性治疗分析, 第78周LDL-C降低幅度(52.4%)略低于第24周(61.0%), 这可能与中途部分患者终止治疗有关。如果仅分析坚持服药的患者资料, 则第78周LDL-C降低幅度(58.0%)更接近第24周(62.8%)。其它血脂指标方面, 试验组第24周非HLD-C下降52.3%, 载脂蛋白B下降54.0%, 总胆固醇下降37.6%, 甘油三酯下降17.3%, 载脂蛋白(a)下降25.6%, 而HDL-C和载脂蛋白A1分别上升4.6%和2.9%(上述所有指标P< 0.001)。
安全性分析:试验组和对照组总不良事件发生率相似, 分别为81.0%和82.5%, 因不良事件导致药物终止率分别为7.2%和5.8%。具体而言, 试验组注射部位反应(5.9% vs. 4.2%)、肌肉痛(5.4% vs. 2.9%)和眼科事件(2.9% vs. 1.9%)发生率均高于对照组、两组未发现溶血性贫血事件, 但均有个别严重神经源性事件和一般过敏性事件发生。两组转氨酶和肌酸激酶升高较罕见且发生率亦相似。
心血管事件:试验组和对照组预设心血管事件发生率分别为4.6%和5.1%。事后分析(post hoc analysis)表明, 试验组预设主要心血管事件发生率低于对照组(1.7% vs. 3.3%; 风险比0.52, 95%可信区间0.31~0.90, P=0.02)。两组累积心血管事件发生率曲线随时间逐渐分离。
与单纯标准降脂治疗相比, PCSK9抑制剂Alirocumab和Evolocumab联合标准降脂治疗, 可以长期、有效降低LDL-C水平和心血管事件发生率。
大量研究证实, 他汀类药物是目前降低LDL-C最有效的手段, 可显著地降低心血管事件和死亡率[1]。然而使用他汀类药物治疗仍面临众多的挑战[2]:①部分患者已接受最大耐受量他汀类药物治疗但LDL-C仍未达标(如家族性高胆固醇血症)或仍存在残余心血管疾病风险; ②他汀类药物副作用(如肝损害、肌痛、横纹肌溶解等)使得部分患者难以耐受或难以足量服用他汀类药物治疗; ③他汀类药物被认为具有潜在增加新发糖尿病的风险。因此, 探索降低LDL-C的新靶点和新疗法成为目前研究的热点问题。
在众多新型降脂药物中, PCSK9抑制剂尤其受到科学家关注。研究发现, PCSK9基因定位于染色体1p3213, 编码前角蛋白转化酶, 若该基因存在功能获得性突变, 可增强PCSK9与LDL-C受体结合并将其内化引导至溶酶体降解, 从而减弱肝脏代谢LDL-C的能力, 上调LDL-C水平[3]。而PCSK9单克隆抗体通过特异性地与PCSK9结合, 阻断其与LDL-C受体的结合, 使得LDL-C的清除率增高, 从而降低LDL-C水平[3]。此外, 人们还关注的是, PCSK9能否在他汀类药物基础上进一步降低血脂。从机制而言, PCSK9降低LDL-C的机制显然不同于他汀类药物抑制HMG-CoA还原酶的作用途径, 可能与他汀类药物具有协同作用。更有趣的是, 研究发现, 他汀类药物可使PCSK9的浓度升高14%~47%, 存在剂量依赖关系, 并且与他汀类药物治疗时间成正比[4]。因此, 研究者猜测PCSK9抑制剂或许可以在他汀类药物治疗之外进一步降低LDL-C。
基于此, PCSK9单克隆抗体Evolocumab和Alirocumab进行了多项Ⅱ 期及Ⅲ 期临床试验。MENDEL试验评价了Evolocumab单药治疗低危高胆固醇血症患者的效果, 结果显示患者LDL-C降低40%~50%[5]。Stein 等针对Alirocumab的研究亦得出相似结果[6]。LAPLACE- TIMI试验则进一步证实, Evolocumab联合他汀类药物治疗高胆固醇血症, 可大幅度降低患者LDL-C水平(41.8%~66.1%), 效果优于单药治疗[7]。对于强化他汀类药物治疗仍无法降脂达标的顽固性高胆固醇血症患者(如杂合家族性高胆固醇血症), RUTHERFORD试验以及Roth教授。Mckenney教授等的研究发现, 加用Evolocumab或Alirocumab最终使LDL-C水平下降43%~72%[8, 9, 10]。此外, 对于他汀类药物不耐受(主要为肌病)的患者, 单用Evolocumab可使LDL-C下降41%~51%, 联合依折麦布降幅可达63%, 显著高于安慰剂/依折麦布组(LDL-C下降15%)[11]。可见, PCSK9可有效解决目前他汀类药物治疗面临的挑战, 成为他汀类药物降脂不达标或他汀类药物不耐受等患者降脂治疗的新手段。
安全性方面, 在Evolocumab或Alirocumab的Ⅱ 、Ⅲ 期临床试验中[5, 6, 7, 8, 9, 10, 11], 最常见的副作用为注射部位的相关反应, 如疼痛或局部皮疹(2%~9%)、上呼吸道感染(6%~10%)、鼻咽炎(4%~15%)及轻度的胃肠道并发症如腹泻(4%)、恶心(4%~6%); 肌酸激酶升高、肌痛的发生率为1.2%~4%。但研究未发现药物与安慰剂的不良反应发生率存在明显差别, 且未发现与治疗确切相关的严重或致命不良反应。
然而, 上述研究仅证实了PCSK9抑制剂的短期有效性及安全性, 且未提供患者心血管事件预后数据。OSLER研究和ODYSSEY LONG TERM研究则旨在回答PCSK9抑制剂的长期有效性、安全性及其对心血管事件的影响。研究表明, 与单纯标准降脂治疗相比, PCSK9抑制剂Evolocumab或Alirocumab联合标准降脂治疗, 可以有效降低LDL-C水平达61%~62%, 且这一降脂效应可持续至48周或72周。同时, 两项研究均发现, 联合治疗可显著减少患者心血管事件发生率(风险比0.47~0.52, P< 0.05)。至于安全性, 联合治疗组和单纯标准降脂组总不良事件发生率、严重不良事件发生率和因不良事件导致药物治疗终止率相似。这两项研究结果为PCSK9抑制剂的长期安全、有效应用提供了有利的依据。
值得注意的是, 极低水平LDL-C亦可能存在潜在风险, 包括出血性卒中。神经认知功能受损、溶血性贫血、激素或维生素缺乏[12]。在这两项研究中, 联合治疗组神经认知不良事件发生率较对照组更高, 尽管研究者分析认为其发生率与LDL-C降低的水平无相关性, 但仍需后续研究进一步证实。同时, 研究者认为, 现阶段的研究仍存在若干不足, 例如入选患者心血管事件危险程度不一致, 总体的不良事件和心血管事件发生率较低, 部分患者中途停止药物治疗, 随访时间相对慢性疾病而言仍较短等, 许多的研究结论仍有待更大规模。更长随访时间的研究证实, 接下来的ODYSSEY OUTCOMES研究(ClinicalTrials NCT01663402, 针对Alirocumab, 计划纳入18 000例患者, 随访5年)[13]和FOURIER研究(ClinicalTrials NCT01764633, 针对Evolocumab, 计划纳入27 500例患者, 随访5年)也许能给我们带来更肯定的回答!
总之, PCSK9抑制剂显示了降低LDL-C的卓越疗效, 有望对调脂治疗带来新的革新; 但其长期有效性、安全性。临床预后, 以及针剂的方便性、价格的可接受性等问题也有待进一步解决。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|