| 程颖, 主任医师, 二级教授, 博士研究生导师, 享受国务院特殊津贴, 卫计委有突出贡献中青年专家。现任吉林省肿瘤医院院长、吉林省肿瘤研究所所长、吉林省抗癌协会理事长; 中国抗癌协会常务理事, 中国临床肿瘤学会(CSCO)副理事长、CSCO小细胞肺癌专家委员会主任委员、中国抗癌协会肺癌专业委员会副主任委员、中国抗癌协会肿瘤临床化疗专业委员会副主任委员、中华医学会肿瘤学分会委员、全国医师定期考核肿瘤专业编辑委员会副主任委员、中国医师协会肺癌专业委员会副主任委员、吉林省医师协会肿瘤医师分会主任委员、吉林省医学会肿瘤专业委员会主任委员等。担任 《中华肿瘤杂志》 、《中华肿瘤防治杂志》 、《中华临床医师杂志(电子版)》 、《临床肿瘤学杂志》 、《实用癌症杂志》、《中国肺癌杂志》、《肿瘤研究与临床》等20余本杂志的常务编委或编委。在国内外发表论文150余篇, 主编专著5部, 承担国家及省市科研课题49项, 包括国家十二五、十一五重大科技攻关、863、国家自然科学基金在内多个科研课题。获得吉林省科技进步一等奖1项, 吉林省自然科学学术成果一等奖2项, 吉林省科技进步二等奖3项、三等奖3项。 |
研究一:George J, Lim JS, Jang SJ, et al. Comprehensive genomic profiles of small cell lung cancer[J]. Nature, 2015, 524(7563): 47-53.
研究二:Niederst MJ, Sequist LV, Poirier JT, et al. RB loss in resistant EGFR mutant lung adenocarcinomas that transform to small-cell lung cancer[J]. Nat Commun, 2015, 6: 6377.
2b。
研究一:小细胞肺癌(small cell lung cancer, SCLC)患者很少接受手术治疗, 因此用于基因组学研究的肿瘤组织有限。既往有小样本研究采用全外显子测序的方法发现了少量的基因改变。
研究二:有个案报道EGFR突变的非小细胞肺癌(non-small cell lung cancer, NSCLC)耐药后转化为SCLC, 同时在其他小样本研究中再活检证实了SCLC的存在, 但其分子机制目前尚不明确。
研究一:探索SCLC全面而复杂的基因改变图谱。
研究二:明确EGFR突变的NSCLC耐药后转化为经典SCLC的分子机制。
研究一:
• 研究条件:德国科隆大学翻译基因组学研究中心和病理科。
• 研究对象:来自于多个研究所的152例Ⅰ ~Ⅳ 期SCLC患者的肿瘤标本。SCLC大鼠模型:TRP53、RB1二联基因敲出(DKO)和TRP53、RB1、RB2三联基因敲出(TKO)。
• 研究方法:全基组测序和全外显子测序。
• 干预措施:将SCLC患者肿瘤标本-80℃保存, 提取DNA进行全基因组测序和全外显子测序; 取DKO 和 TKO 大鼠模型的肿瘤进行全基因组和全外显子测序。
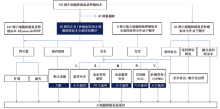
• 研究流程:见图1。
• 评价指标:110例患者肿瘤的全基因测序数据主要分析反复出现的突变基因。大鼠肿瘤基因和既往人工构建的SCLC大鼠模型GEMM和数据库Cancer Gene Census 14 COSMIC的SCLC突变基因进行对比。
研究二:
• 研究条件:美国麻省总医院肿瘤中心和美国哈佛大学医学研究中心。
• 研究对象:来源于9例EGFR突变的NSCLC EGFR-TKI耐药后转化为SCLC患者的11例肿瘤标本。两个临床模型(MGH131-1 和MGH131-2)分别来自2例EGFR-TKI耐药后转化为SCLC患者的肿瘤标本原代培养形成。
• 研究方法:二代测序、CGH、qPCR 和IHC方法比较耐药后SCLC和耐药前NSCLC的分子特点。
• 干预措施:在EGFR突变的细胞中敲除RB1基因; BCL2靶向药物干预转化为SCLC的细胞系。
• 评价指标:RB1、EGFR、神经内分泌标志物表达变化。
研究一:
(1) SCLC的基因改变图谱:G蛋白偶联受体信号通路中的重要基因:TP53和RB1、KIAA1211和COL22A1、RGS7和FPR1; 在> 8%的标本中反复多次出现的基因:TP53、RB1或RB2、TP73; 错配修复基因:TP53、RB1、CREBBP和COL22A1 ; 抑癌基因:FMN2、NOTHC1、NOTCH3; 其他:PTET、RBL1、RBL2、BRAF, KIT、PIK3CA基因突变。以上五大基因改变相互排斥, 并无相关性。同时这些基因与总的基因突变数量、总体生存时间和其他临床特点都无相关性。
(2) 在108例无染色体断裂的肿瘤标本中, TP53和RB1分别占100%和93%(主要表现为失活)。TP53和RB1抑癌基因失活是导致SCLC形成的必备因素。
(3) TP73基因突变和基因重排发生率为13%, 同时第一次发现p73Dex2/3变异体作为精准的基因重排结构出现。
(4) 发现并证实了NOTHC是SCLC肿瘤抑癌基因, 同时在神经内分泌调节分化过程中起重要作用。
研究二:
(1) 耐药后含EGFR突变的SCLC(MGH131-1 和 MGH131-2)神经内分泌标志物表达阳性, mRNA 和 miRNA也倾向于经典SCLC表现。
(2) 耐药后含EGFR突变的SCLC(MGH131-1 和 MGH131-2 )对EGFR-TKI耐药, 包括三代EGFR-TKI(WZ4002); EGFR mRNA表达水平比耐药前NSCLC明显下降。
(3) 通过比较MGH131-1、MGH131-2 与其他21株经典SCLC细胞系发现, MGH131-1和 MGH131-2对ABT-263敏感性最好。因此, ABT-263可能是治疗耐药后EGFR突变的SCLC最有效的治疗方案。
(4) 本研究发现MGH131-1、MGH131-2 细胞中RB1基因失活。RB1抑癌基因失活可能是导致形成SCLC的重要原因, 但若仅有RB1抑癌基因失活不一定能形成SCLC。
研究一:RB1和P53抑癌基因失活是形成SCLC的主要基因改变, 其他包括TP73突变和NOTHC信号通路活化等。
研究二:EGFR突变的NSCLC耐药后转化为SCLC后表现为经典SCLC的分子特点并对SCLC的治疗方案敏感。
肺癌治疗领域EGFR-TKI和ALK抑制剂的研发历史告诉人们, 找到肿瘤明确的驱动基因对于开发新药、选择合适治疗人群、保证靶向药物的治疗疗效具有重要意义。因此, 采用下一代测序技术(next-generation sequencing, NGS)全面解析难治肿瘤的基因组学特征显得尤为重要。
2005年, 平行焦磷酸测序拉开了NGS的序幕, 目前, NGS已经发展到了第三代, 高通量的NGS检测仪器也获得美国FDA的批准用于临床检测。早在2008年, 美国Cancer Genome Atlas Research Network(TCGA)报道了第一个实体肿瘤全基因组测序结果。在肺癌研究领域, 2012年TCGA公布了肺鳞状细胞癌的全基因组测序结果, 2014年又公布了肺腺癌的全基因组测序结果, 开启了NSCLC的精准医学时代。
然而SCLC由于组织标本不足, 基因组复杂, 研究进展缓慢。直到2010年在《Nature》上才发表了第一个SCLC细胞系NCI-H209全基因组测序结果。2年后《Nature Genetics》上同时刊登了2篇SCLC基因组测序结果。随后日韩陆续报道了小样本研究。这些研究除常见的TP53和RB1失活突变外, 在不同的研究中其他高频率的突变谱并不一致。
2015年发表的这篇SCLC全基因组测序研究(Comprehensive genomic profiles of small cell lung cancer)是由Peifer M、Sage J、Thomas RK作为共同联合通讯作者, 整合了亚洲及欧美多个国家的科研人员进行的迄今样本量最大、第一篇全面分析SCLC体细胞突变基因组特征的研究。部分研究者也参与了2012年发表在《Nature Genetics》上的SCLC的全基因组测序研究。该研究对110例肿瘤和配对标本进行了全基因组分析, 除了验证了以往的一些基因组学检测结果, 如SCLC普遍存在TP53和RB1基因失活、具有高频率的MYC扩增、BRAF、KIT和PIK3CA突变外, 不存在目前已知的可用于靶向治疗的靶点。该研究的新发现之一是在13%的SCLC中检测到TP73基因突变或重排, 证实基因重排产生的TP73Dex2/3具有抑制野生型TP53的功能, 可能发挥致癌基因的作用, 或将成为SCLC的新的潜在治疗靶点。由于TP53和RB失活目前还无法实现针对性的靶向治疗, TP73是否是一个有应用前景的靶点还需更多的研究。新发现之二是通过动物模型明确了Notch信号通路的重要作用:SCLC中Notch信号通路活性降低, 具有抑癌作用, 且参与SCLC的神经内分泌分化。与这项研究相呼应的是一些有关针对Notch信号通路的新药研究, 如SC16LD6.5, 临床前研究证实SC16LD6.5治疗荷瘤小鼠有效, Ⅰ /Ⅱ 期研究(n=73)确定SC16LD6.5的临床应答剂量为0.2~0.4 mg/kg, 其治疗效果可能与DLL3的表达情况相关。
尽管标本的采集困难限制了对SCLC全基因组和生物学特性的研究, 但是随着越来越多的报道发表, 一些公认的SCLC生物学信息被逐渐验证。近年来也有研究者通过液态生物标本进行SCLC全基因组研究, 如采用ctDNA和CTC等。相信随着标本采集技术和高灵敏性检测技术的不断发展, 加之人们对于SCLC研究的更加关注, 对SCLC这种恶性度极高疾病的生物学解读也会越来越全面。
EGFR敏感突变的NSCLC患者经EGFR-TKI治疗后发生耐药是目前临床面临的一个治疗难题, 5%~15%的耐药患者在肿瘤形态学上表现为耐药SCLC转化, 此类患者采用经典SCLC化疗方案治疗有效。然而EGFR-TKI耐药SCLC转化还有其独特特点, 虽然形态学表现为SCLC, 但仍保留EGFR敏感突变, 耐药SCLC转化的产生机制及分子生物学特征如何至今未知。
文章《RB loss in resistant EGFR mutant lung adenocarcinomas that transform to small-cell lung cancer》报道的是由在EGFR-TKI靶向治疗领域和SCLC研究领域的顶级专家们联手进行的又一次突破性研究, 旨在发现EGFR-TKI耐药SCLC转化的发生机制及基因特征。
该研究对耐药后SCLC进行了全面且完整的分析, 在试验设计方面非常严谨和系统。对EGFR-TKI耐药后转化为SCLC和未转化肿瘤进行了比较; 还对比了EGFR-TKI耐药后的组织、组织衍生的细胞系及经典SCLC以及原发灶和转移灶的差异; 不仅分析了EGFR突变和EGFR表达, 还进行了遗传学和表观遗传学的分析; 除了进行了体外实验, 还采用动物模型进行了体内实验。
该研究的重要发现在于EGFR-TKI耐药SCLC转化与经典SCLC基因方面非常相似, 如EGFR蛋白低表达和P53缺失, 但未发现MYC、PTEN和FGFR1缺失。值得注意的是, 在11例耐药SCLC转化标本中, 均存在RB基因和蛋白表达缺失。但是下调吉非替尼敏感NSCLC细胞系中RB的表达, 并没有诱导耐药发生, 也没有改变NSCLC细胞系的NE标志物的表达和表型转化。然而体外研究不能完全模拟体内的情况, 体内的多潜能细胞在RB基因缺失且EGFR活性突变存在的情况下, 可能会在耐药后NSCLC向SCLC转化过程中起到关键作用, 但尚需进一步研究证实。同时本研究也对发生SCLC转化后的治疗进行了探索, 研究发现BCL-XL的抑制剂ABT-263对于耐药后SCLC转化的抑制效果优于非转化的NSCLC, 这为EGFR-TKI耐药后的治疗又提供了一个新的靶点, 也为ABT-263治疗SCLC只是在部分患者中有效提供了新的研究思路。
导致EGFR-TKI耐药的机制众多, 目前针对c-Met扩增、T790M突变等这些机制也陆续研发出新的靶向药物来克服耐药。该文发现耐药后SCLC转化肿瘤不仅在基因方面与经典SCLC相似, 而且对经典SCLC的治疗药物也敏感, 提示我们未来克服EGFR-TKI耐药后SCLC转化还需要借鉴经典SCLC的研究, 包括经典SCLC标本的全基因组测序和更多的对潜在基因靶点的验证。
The authors have declared that no competing interests exist.