| 宋勇, 医学博士、教授、主任医师、博士研究生导师。南京军区总医院呼吸内科主任、肺癌综合诊治中心主任。南京大学、南方医科大学、南京医科大学和第二军医大学博士研究生导师, 南京军区南京总医院博士后联系导师。 解放军呼吸内科专业委员会副主任委员、南京军区呼吸内科委员会主任委员、江苏省医学会呼吸分会副主任委员兼肺癌学组组长、中国抗癌协会肺癌专业委员会委员, 国际肺癌研究组织(IASLC)会员、《Translational Lung Cancer Research》杂志(PubMed收录)主编, 《Journal of Thoracic Disease》杂志(SCI收录)编委, 《医学研究生学报》副主编, JTO中文版、《中国肺癌杂志》、《中华肺部疾病杂志》等多本杂志常务编委和编委。曾在美国科罗拉多大学医学院学习和工作3年余。主持国家自然科学基金、国家新药基金等多项课题。长期从事呼吸内科临床和科研, 尤其在胸部肿瘤多学科诊治方面具有丰富的经验。在国内外学术期刊发表论文300余篇, 获得省部级二等奖4项。 |
研究一:Izumchenko E, Chang X, Brait M, et al. Targeted sequencing reveals clonal genetic changes in the progression of early lung neoplasms and paired circulating DNA[J]. Nat Commun, 2015, 6: 8258.
研究二:Wu K, Zhang X, Li F, et al. Frequent alterations in cytoskeleton remodelling genes in primary and metastatic lung adenocarcinomas[J]. Nat Commun, 2015, 6: 10131.
2b。
肺腺癌是非小细胞肺癌中发病率最高的病理类型。然而, 尽管近年来肺癌手术技术、分子分型、靶向治疗等方面的研究进展很快, 肺腺癌的预后仍无明显改善。究其原因, 不外乎以下几点:(1)疾病诊断时患者多已为局部或远处转移的晚期; (2)半数以上的肺癌缺乏已知的有靶点的驱动基因; (3)极其复杂的瘤间和瘤内异质性; (4)尚不明确疾病转移的发生发展机制及其相应的治疗措施。既往研究已发现多种有靶点的驱动基因且部分已有靶向治疗药物, 如EGFR、ERBB2、BRAF、ALK/ROS1/RET等; 但种族异质性、瘤间和瘤内异质性的存在使得现有研究难以完全阐释肿瘤基因突变的全貌, 极大地阻碍了个体化治疗的步伐。
肺腺癌的新病理分类在一定程度上体现了其早期的进化步骤。非典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)被认为是肺结节恶化进展的第一步; 原位腺癌(adenocarcinoma in situ, AIS)病灶增大、异型性细胞增多, 距离恶性肺癌更近一步。微浸润腺癌(minimally invasive adenocarcinoma, MIA)病灶小于3 cm、以贴壁样生长为主且浸润小于5 mm。AAH、AIS、MIA的恶性程度逐级增加; 通过深度测序细究其发生发展过程中不同时间点上出现的活化基因突变, 可以进一步阐释“ 进化树理论” 并提高早期诊断率。而晚期肺癌转移的偏好性及预后所揭示的肿瘤生物学特性目前尚无定论; 深度测序原发灶和转移灶基因突变并分析二者的异同, 不仅能够扩大肿瘤突变谱以了解肿瘤全貌, 也能探索潜在的转移机制以指导治疗。
研究一:探索早期肺腺癌发病机理过程中的常见体细胞突变、个体间及瘤间的特定突变及突变频谱。
研究二:探索晚期肺癌转移的活化通路、基因突变及其发生发展的机制。
研究一:
• 研究条件:美国Johns Hopkins医学研究中心。
• 研究方法:单中心、非盲、回顾性对照临床研究。
• 研究对象:诊断为肺浸润性腺癌并接受手术切除的初治病例。
• 干预措施及评价指标:
肺浸润性腺癌患者经病理再次确认并存在AAH成分的6例(病灶共取25个区域)、AIS(每个病灶取3个区域)或MIA成分(每个病灶取4个区域)各5例。其中, AIS患者包括肿瘤中央所含细胞异型性最大的区域(Zone 3)、MIA患者包括微小浸润(小于5 mm)的区域(Zone 4)。入组病例的正常淋巴结、血浆及其中2例患者的痰标本作为配对, 同样进行后续分析。
经病理确认且肿瘤细胞> 60%的肿瘤组织、配对的正常淋巴结组织、血浆经处理后提取足量DNA:(1)CancerSelect-R嵌板分析肿瘤组织125个实体瘤常见的体细胞突变、拷贝数改变、碱基置换等; (2)目标捕获肿瘤细胞并行二代测序(next generation sequencing, NGS)作后续生物信息分析; (3)应用ddPCR技术分析入组病例的血浆DNA; (4)上述基因信息再行种系发生的进化分析及突变网络分析。
研究二:
• 研究条件: 中国广州医科大学第一附属医院胸外科。
• 研究方法:单中心、非盲、回顾性对照临床研究。
• 研究对象:术前未经任何治疗、经手术病理诊断确认的肺腺癌患者。
• 干预措施:手术标本病理诊断标准:(1)肿瘤组织的肿瘤细胞> 50%; (2)转移性淋巴结的肿瘤细胞> 30%。最终入组335例肺腺癌患者(其中101例作为训练集, 234例作为验证集)。收集每例患者的肿瘤组织、癌旁正常组织以及配对的转移性恶性淋巴结(35例)。入组病例术后常规每3个月随访, 中位随访期达36个月。
• 评价指标:入组病例的标本经QIAamp DNA Mini Kit (Qiagen)、TRIzol Reagents(Life Technologies)分别提取基因组DNA、总RNA:(1)进行全基因组测序(whole genome sequencing, WGS)及全外显子测序(whole exons sequencing, WES); (2)检测得出的体细胞突变经质谱或目标区域捕获的二次测序进行再次确认; (3)基于WGS数据进行突变特征分析(n=24); (4)分析发现可能的肺腺癌重要突变基因; (5)RNA转录组测序分析; (6)WGS数据分析发现融合基因, 并再经PCR或Sanger测序验证; (7)通路富集分析及突变网络分析。
研究一:
(1)AAH、AIS、MIA的突变全貌
AAH、AIS、MIA的突变全貌见表1。
| 表1 AAH、AIS、MIA 的突变全貌 |
(2)肿瘤发生发展过程中的突变全貌
尽管AAH和MIA有较多的共有突变, 但特性突变仅发生于异质性相对较高的AIS。而AAH的交互突变率最高, 提示其多样性最强、能够影响癌前病变的分子通路。AAH、AIS、MIA共有突变为EGFR、TP53、IGF1R; 前两者突变频率随着肿瘤恶性程度的增高而升高, 与肿瘤突变全貌密切相关, 且与其肿瘤发生的驱动性相一致。碱基转换分析可见, AIS的C-T率明显升高而C-A率降低, 提示AIS突变率较高、突变频谱较宽。而TP53、EGFR双突变的存在可能是促进肿瘤恶性转化的重要驱动因素。
(3)早期肺癌的瘤内异质性
同一病灶中的不同区域所共有的突变多为已知的驱动基因, 如EGFR、TP53、KRAS、ATRX等, 说明驱动基因突变发生于肿瘤进化的早期阶段。尽管AIS已有克隆进化的远距离突变, 但MIA的不同区域仍有共同突变, 说明其支干基因进化与后续克隆扩增相一致。
(4)液体活检检测肿瘤相关DNA
肿瘤组织经NGS检测出的突变, 在血浆和痰标本提取的DNA中使用ddPCR仍能检测得到。但肿瘤原发灶和液体标本所检测的量化突变丰度并无明显关联。且液体活检DNA可检测到肿瘤组织中未能检测出的突变, 如BRAF p.469G> A。
研究二:
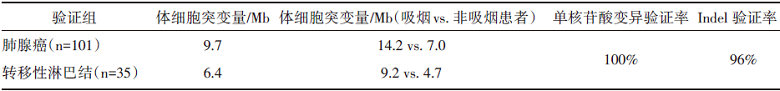
(1)体细胞DNA突变及验证
体细胞DNA突变及验证结果见表2。
| 表2 体细胞DNA 突变及验证结果 |
(2)肺腺癌突变特性
发现集的突变谱分析可见C-A颠换和C-T转换是最常见的体细胞碱基替换。24例经全基因组测序, 结果显示特征1~4在原发灶和转移灶中并无明显差异; 与欧洲肺腺癌患者基因数据对比显示, 与吸烟相关的C> A突变在中国基因特征1和欧洲基因特征1均较高。虽然原发灶和转移灶的突变特征相似, 但仍有33%(8/24)存在不同的基因特征分布, 考虑是瘤间异质性或转移过程中的突变选择所致。
(3)重要突变基因分析
经MutSig算法整合335例肺腺癌及35例转移淋巴结的全部突变信息, 发现了13个有统计学意义的重要突变基因。肺腺癌原发灶最常见的突变基因为TP53 (44%)、EGFR (39%)、LRP1B (19%) 和KRAS(11%), 这些基因在肿瘤发生过程中起着重要作用。其他基因还包括PTPRD (7%)、STK11 (4%)、MAD2 (2%)、PIK3CA (5%)、BRAF (4%)和FLT1 (3%)。与既往研究相同, KRAS与EGFR突变互不共存, 且KRAS多见于吸烟患者。RHPN2 (5%)、GLI3 (4%) 和MRC2 (2%)未曾报道为肺腺癌的驱动基因, 但三者分别在肿瘤浸润、晚期肺癌进展、肿瘤生长和驱动转移等方面作用显著。
入组患者分为229例有转移和105例无转移两组, 可见TP53是唯一差异有统计学意义的基因, 提示该抑癌基因有使原发灶发生和促进肿瘤转移等方面的作用。而所有335例患者和验证集的234例患者的生存分析显示, 有TP53、LRP1B、STK11、KEAP1、BRAF、MET和MRC2突变患者的生存预后明显较差, 提示这些基因可以应用于临床以预测预后。
(4)体细胞拷贝数变异及mRNA表达谱
研究者分析了发现集101例原发灶和35例转移灶的体细胞拷贝数变异; 通过聚类分析分为三组。生存分析显示具有KRAS、FLT1、KEAP1突变和CEP72扩增较多的第三组, 其生存预后较差; 且第三组患者参与PI3K-Akt通路或细胞骨架重塑过程的基因(诸如PIK3CA、PKN2、PTK2、DOCK1、SOS1和MAPK1)表达水平升高, 提示这些过程的活化可能与疾病进展有关。
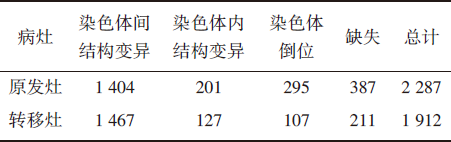
(5)体细胞结构变异
WGS分析可见原发灶和转移灶中分别有2 287和1 912个体细胞结构变异, 见表3。
| 表3 原发灶和转移灶的体细胞结构变异 |
24例转移灶的全基因组和全转录物组测序分析发现了113个基因-基因融合事件; 其中包括IQGAP3、EPB41、CDC42、PARD6G、PTK2B和KALRN等与细胞骨架调节重塑相关的基因, 提示上述基因能够促进肿瘤转移进展。
(6)IQGAP3基因的位点分析
该基因可见于发现集(n=101)的10%病例中, 其中3例为体细胞突变、7例为拷贝数扩增、1例为基因移位。而验证集(n=234)中另有8例为IQGAP3体细胞突变。进一步分析显示, IQGAP3可见于132例患者(其中发现组61例、验证组71例); 而IQGAP3高表达是预后较差的独立风险因素(风险比2.28, 95%可信区间1.25~4.14, P=0.007)。
(7)关键通路的改变及相应的治疗靶点
P53信号和细胞循环通路改变发生率最高, 可见于87%的原发灶和89%的转移灶; 其中体细胞突变多为TP53、MDM2、MYC、CCND1、CCNE2、CDK4和CDK6扩增, 以及CDKN2A、CDKN2B缺失等功能丧失变异体。其次, RTK/RAS/PI3K通路改变发生率亦较高, 可见于88%的原发灶和80%的转移灶; 其中多包括有治疗靶点的突变, 如EGFR、PIK3CA、ALK、ERBB2、MET、AKT1和mTOR。
另外, 与细胞骨架重塑肌动蛋白和黏着斑相关的通路在50%的肺腺癌中常发生变异, 包括IQGAP3、RHPN2、RAC1、RAC3、TRIO和CDC42。这两个通路的基因在细胞迁移、运动、粘连和细胞交互作用中极为重要。网络分析进一步扩展了促进细胞骨架重塑调节所涉及的基因和通路之间的联系; 而这类变异发生于77%的转移灶, 明显高于原发灶(仅50%), 再次提示该基因和通路改变在驱动肿瘤转移中所起的重要作用。
研究一:瘤内驱动基因存在异质性; 克隆扩增是导致肿瘤发生的早期事件, 且通过ddPCR液体活检可早期检测该事件。
研究二:转移病灶的IQGAP3表达水平较高, 是预后较差的因素。基因调控的细胞骨架重塑过程突变较多, 尤其在IQGAP3高表达的转移病灶。
靶向治疗正在肺癌患者的治疗过程中发挥着越来越重要的地位, 而寻找肺癌患者可能存在的治疗靶点的重要性也日益凸显。测序技术能够对患者的基因状态更全面地进行检测, 以前我们总说“ no meat, no treat” , 因为我们需要根据患者的组织学类型为患者提供化疗决策; 而现在我们可以说“ no test, no treat” , 因为基于生物标志物选择患者的治疗模式, 大大改善了癌症患者的预后。我们甚至不满足于对每一位患者进行特定位点的基因检测, 期待着能够在患者疾病发展的每一个阶段、在患者的每一个治疗决策之前能有更为全景的基因层面的信息, 同时二代测序技术也为肿瘤的发生、发展的研究提供了更多的可能[1, 2]。
《Nature Communications》近期发表了两篇关于肺癌患者的测序研究, 第一篇研究来自美国约翰霍普金斯大学, 该研究是基于对于肺腺癌类型的重新界定[3], 以及AAH、AIS、MIA至浸润性腺癌的逐步发展过程的理论, 对所获得这三类组织进行二代测序检测, 并对其中2例患者进行外周血或痰液的基因检测, 有两个非常重要的发现:(1)KRAS、TP53及EGFR突变与肿瘤的恶性转化相关; (2)AAH、AIS、MIA病变的不同部位与浸润性腺癌一样, 同样存在基因突变的异质性。
EGFR及TP53在肺癌中的作用已经较为明确, 这项研究更加提示了二者的重要性:(1)在肿瘤发生过程的最早阶段即可检测出EGFR及TP53突变(有可能成为肿瘤发生的始动过程); (2)从AHH、AIS、MIA至浸润性腺癌, 疾病的每一个过程均可发现EGFR及TP53突变(对于肿瘤从发生至浸润性腺癌的维持至关重要); (3)随着疾病的发展, 二者突变的概率逐步增高, 如果病变到达了MIA阶段, 那么基本上都会伴有EGFR及TP53突变的出现(提示二者对于疾病的不断进展同样具有一定意义)。并进一步证实KRAS同样为肿瘤发生发展的早期事件。
我们一直在追求对肺癌患者进行“ 早诊断、早治疗” , 既然在疾病发生的始动阶段即可发现基因层面的信息改变, 那么更早地对患者进行基因诊断, 是否能够更好地实现我们早期诊断的目的呢?同时, 对于外周血及痰液进行ddPCR检测, 一定程度上是否也可取代组织的基因检测, 更为便捷地提供基因信息呢?该研究对这两个问题都给出了正面的回答, 具有重要的临床意义。其特别之处应该是对患者疾病发展的不同阶段的组织进行了分析和解读, 但是该研究并未对基因层面的信息进行全面的分析, 而是选取了其中125个较为明确的基因进行检测, 对于未检测基因信息的遗漏是不可避免的; 同时样本量较少也是不能不考虑的问题(AAH为6例患者, AIS、MIA分别为5例患者), 这些患者的检测结果是否具有足够的代表性尚需斟酌。
第二项研究来自中国学者, 是目前最早的在中国肺癌患者中开展的全基因组测序研究, 共纳入335例肺癌患者, 其中35例患者有配对的转移性淋巴结标本, 发现了13个突变基因, 包括最常见的TP53, 还有RHPN1、GLI3和MRC2; 而TP53基因在转移患者中显著高于无转移病变的患者; 调节细胞骨架重塑的基因同样发生了较为明显的变化, 其中IQGAP3与患者的预后密切相关。
该研究更为直观地指出了亚裔人群与高加索人群在突变状态上的变化:EGFR突变(尤其是21外显子L858R突变)在亚裔人群中更为常见; 而KRAS作为高加索人群的第二大突变基因, 在亚裔人群中突变率仅为11%, 也进一步证实了KRAS突变在原发病灶及转移病灶中的状态的不一致[4]。
在方法学方面, 该研究样本量较大; 先进行全基因组检测, 然后在更大样本中进行验证; 35例患者还具有原发病变及配对的转移性淋巴结标本。但是淋巴结转移病灶的样本量相对较小, 且淋巴结标本尚不可完全代表远处转移病变的基因突变状态, 对于骨转移、脑转移等病变的研究可能更能代表肺癌在侵袭过程中的生物学特性。
综合而言, 这两项研究都是以基因检测为基础的观察性研究, 进行了较大量的检测和分析, 都关注肺癌发展过程中的基因状态的变化(从AAH、AIS、MIA到浸润性腺癌, 再到转移性淋巴结, 肿瘤发展的每一个过程中, 基因层面的信息似乎都有迹可循), 其中TP53是这两项研究共同强调的在肺癌发生、发展中发挥作用的突变基因。在我们对于肿瘤生物学特性并不完全了解的今天, 对于基因层面的每一次研究都是有意义的, 是新的靶向药物不断出现的基础。但是测序研究的数据量较为庞大, 如何在浩瀚的数据中寻找对我们有用的信息, 尚需不断探索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|