| 王洁, 中国医学科学院肿瘤医院内科主任医师、教授、博士研究生导师。国家杰出青年基金获得者, 获第七届中国青年女科学家奖, 为教育部创新团队带头人, 2014年入选国家百千万人才工程并获有突出贡献中青年专家称号, 国务院政府特殊津贴享受者。中国抗癌协会肺癌专业委员会常委, 中国临床肿瘤学会执行委员, 北京医学会肿瘤学分会副主任委员。担任《中华结核与呼吸杂志》、《中国肺癌杂志》、《Lung Cancer》、《Clin Lung Cancer》编委。作为课题负责人多次承担国家自然科学基金重点及面上、国家863科技支撑项目。在国内外肿瘤核心期刊《J Clin Oncol》、《Cancer Res》、《Clin Cancer Res》及《PNAS》等杂志发表论文百余篇。 |
研究一:Gorges TM, Penkalla N, Schalk T, et al. Enumeration and molecular characterization of tumor cells in lung cancer patients using a novel in vivo device for capturing circulating tumor cells[J]. Clin Cancer Res, 2015, Dec 14. pii: clincanres. 1416.2015. [Epub ahead of print]
研究二:Sundaresan TK, Sequist LV, Heymach JV, et al. Detection of T790M, the acquired resistance EGFR mutation, by tumor biopsy versus noninvasive blood-based analyses[J]. Clin Cancer Res, 2015, Oct 7. [Epub ahead of print]
2b。
目前, 病理活检是肺癌患者临床诊断的金标准, 也是基因分型诊断的金标准。但由于活检的有创性, 临床上往往难以进行多次活检获得足够的组织标本, 而“ 液体活检” 循环肿瘤细胞(circulating tumor cell, CTC)和循环肿瘤DNA(circulating tumor DNA, ctDNA), 因操作方便、无创、全面地反应整体情况, 近年来成为研究热点。
“ 液体活检” 可辅助甚至替代组织标本作为临床的诊断、监测指标, 例如外周血表皮生长因子受体(epidermal growth factor receptor, EGFR)动态检测可监测酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)的疗效及预后, 外周血CTC数量可能与疗效、预后等相关。尽管如此, 因CTC、ctDNA分离技术及分子检测方法尚无统一标准, 导致检测结果与肿瘤组织存在不一致性。因此, 建立高敏感度、高特异性、高一致率的检测方法对“ 液体活检” 的推广应用具有重大意义。
研究一:探索CellCollector® 平台对肺癌患者外周血CTC的捕捉以及进行分子分型的可行性, 比较与目前FDA批准的CellSearch® 平台的优劣性。
研究二:分析比较配对的组织标本及外周血CTC、ctDNA检测T790M突变的结果。
研究一:
• 研究条件:德国乌尔姆大学医学中心单中心进行。
• 研究起止时间:2012年1月至12月。
• 研究方法:单中心、开放性、前瞻性观察性研究。
• 研究对象:首诊Ⅲ 期或Ⅳ 期的肺癌患者, PS评分为0或1(能耐受全身抗肿瘤治疗), 无其他特殊的排除标准。
• 干预措施:共入组50名肺癌患者, 在治疗前及治疗后每12周分别用CellSearch® 和CellCollector® 平台对患者进行外周血CTC的分离, 其中CellCollector® 需重复1次。
• 评价指标:主要评价指标为治疗前(基线)及治疗后12周外周血CTC数量, 次要评价指标为治疗后第24周、36周外周血CTC数量。
研究二:
• 研究条件:美国麻省总医院肿瘤中心等多中心参与。
• 研究起止时间:2012-2013年。
• 研究方法:多中心、开放性、前瞻性观察性研究。
• 研究对象:晚期伴EGFR突变、经吉非替尼或厄洛替尼治疗进展、并进行了二次活检的非小细胞肺癌患者。Ⅲ 期的患者若在局部治疗后出现疾病复发同时满足以上条件, 也可纳入此研究。
• 干预措施:共入组42例患者, 在两次活检的前后30天内采集3管10 mL EDTA抗凝血, 分离提取外周血CTC及ctDNA进行EGFR基因检测。
• 评价指标:主要评价指标为肿瘤组织与外周血CTC检测EGFR基因突变的一致性, 次要评价指标为肿瘤组织与外周血ctDNA检测EGFR基因突变的一致性。
研究一:
• 患者特征:主要为腺癌患者(60%), 78%患者有远处转移, 80%的患者肿瘤大小达到T3或T4水平。
• CTC数量及其与临床特征的关系:CTC数量与TNM、UICC分期无明显的相关性; 治疗前(基线)和治疗后12周分别有78%和72%患者能检测出≥ 1个CTC, 而且CellCollector® 平台同期两次检测的CTC数量结果均有显著的相关性, 但在第24周无相关性, 第36周因只检测了1例患者不纳入分析。
CellCollector® 与CellSearch® 平台的比较:在84个标本中, CellCollector® 的检出率为60%~63%, 而CellSearch® 只有27%, 前者的敏感性比后者高。
• 治疗过程中CTC的动态变化:在疗效为完全缓解和部分缓解的患者中, 一线治疗12周后中位下降了8.25个CTC, 而疗效为疾病稳定的患者前后无变化, 疾病进展的患者则反而中位升高了4.5个CTC。然而, 在CellSearch® 检测中并未看到CTC数量有上述的变化。
• CTC的基因分析:用其中2名患者分离得到的CTC进行数字PCR检测, 同样能检测出跟原发灶一样的EGFR及KRAS突变。
研究二:
• 患者特征:主要为中老年、Ⅳ 期、女性患者, 中位年龄为63岁(44~90岁), 29例(73%)患者为19外显子缺失突变, 8例(20%)为21外显子L858R突变, 3例(8%)为其他类型突变。
• 组织EGFR检测:在纳入分析的40例患者中(每例患者至少有一次活检标本), 共有25例(63%)患者检测出T790M突变。
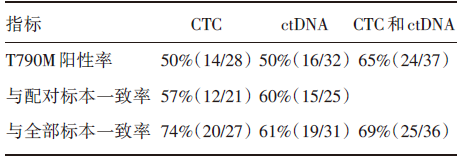
• CTC及ctDNA的EGFR检测及其与组织的一致性见表1。在28例能获得足够CTC的患者中, 共14例(50%)检测出T790M突变。CTC与肿瘤组织T790M检测一致率达到74%。此外, 在32例有足够ctDNA的患者中, T790M的检出率为50%(16例), 而与肿瘤组织检测的一致率为61%。CTC及ctDNA与肿瘤组织检测T790M的总体一致率则为69%, 检出率为65%。
| 表1 CTC 及ctDNA 的T790M 检测结果汇总 |
液体活检具有微创、方便快捷等特点, 可实现临床上对患者进行连续动态的监测, 可帮助医生对患者进行更全面的评估, 具有巨大的临床应用前景。
随着肿瘤分子遗传学和分子病理学研究的深入, 肺癌已被认为是一组基因驱动的疾病而非传统意义的一种疾病。在众多基因型非小细胞肺癌中, EGFR突变是亚洲患者最为常见的基因变异, 故EGFR-TKI 是应用最为广泛、最值得关注的靶向药物。近年来, 对EGFR突变型非小细胞肺癌的异质性和耐药机制的纵深研究, 已经促使既往传统的单基因、定性、静态检测向多基因、定量、动态检测转化, 建立实时、动态、定量的驱动基因检测体系已成为实现精准靶向治疗的基石[1, 2]。ctDNA和CTC因其来自于肿瘤原发灶、转移灶不同区域坏死凋亡的肿瘤细胞碎片或完整脱落、无损的肿瘤细胞, 被认为能够克服肿瘤组织的遗传异质性, 更全面地反映整个肿瘤的遗传学特征, 且易动态获取而义不容辞地成为目前研究的热点[3, 4]。
但基于CTC和ctDNA的驱动基因检测无论在检测技术抑或基因的动态变化层面均存在诸多挑战性问题而限制其临床应用。首先, 多项回顾性研究显示, 外周血EGFR突变检测具有高的特异性及对EGFR-TKI治疗疗效预测的准确性, 但敏感性徘徊于50%~70%, 是外周血检测临床应用的瓶颈; 其次, 目前的研究尚未明确EGFR-TKI治疗过程中敏感和耐药基因的动态变化规律, 尤其T790M突变这一最主要的耐药基因在不同生物标本中的状态、何时出现于外周血中及其丰度与临床耐药的关系知之甚少[5, 6, 7], 致预防性的抗EGFR-TKI耐药治疗成为空中楼阁。最后, CTC的分选技术匮乏及兼具高敏感性和高特异性的基于ctDNA/CTC驱动基因分析技术缺乏大样本、前瞻性研究证实, 均限制了外周血基因检测的临床应用[8, 9]。
Sundaresan等的研究前瞻性地纳入40例携带EGFR敏感性突变、接受EGFR-TKI治疗后进展的患者, 分别检测两次活检组织标本和CTC/ctDNA中T790M的突变情况。结果显示T790M突变阳性率在组织中为63%, CTC中50%, ctDNA中50%, 组织与CTC T790M检测一致率达74%, 与ctDNA的一致率为61%, 同时ctDNA/CTC与肿瘤组织T790M检测的总体一致性可达69%。该研究首次前瞻性地比较EGFR-TKI耐药后同一时间点两次活检组织标本与配对的CTC/ctDNA T790M的状态及三种生物标本耐药基因的一致性, 此为该研究设计上的亮点。此项研究亦挑战了组织作为T790M检测金标准的老大地位。在15例组织T790M阴性患者中, 7例在ctDNA/CTC中检测到T790M阳性, 且90%患者的T790M在ctDNA、CTC 同时存在, 提示三种生物标本基因检测互为补充, 方能更好地反映肿瘤遗传学的本质与全貌, 并首次提出未来的金标准可能既非肿瘤组织, 亦非外周血检测, 而应以临床远近期疗效作为评价指标。此为本研究的又一大亮点。
该研究的不足之处归纳为两方面:其一, 标本量少, 尤其同时具有三种标本的患者仅16例, 影响了后续分析的可信度, 其二, 此研究缺乏三代药物治疗的疗效分析, 尤其缺乏外周血T790M阳性但配对组织标本阴性的7例患者AZD9291治疗的数据。
CTC系从肿瘤组织中释放入血的完整的肿瘤细胞, 是转移的必经之路。利用CTC不仅能分析所有的耐药基因, 亦可进行免疫表型检测和基因组学、转录组学分析。尤其可精准到单个肿瘤细胞间的基因、拷贝数分析, 是研究异质性和克隆进化的绝好模型。但上述目标的实现均依赖于高效的CTC分选技术。Gorges等的研究则通过单中心、开放性、前瞻性研究, 评价了新的CellCollector® 技术与FDA认证的CellSearch® 系统对晚期患者的CTC捕捉能力、CTC数量动态改变以及在此基础上进行的基因检测的差异。显示CellCollector® 在CTC分选技术上的优势(CTC检出率60%~63% vs. 27%)、在治疗过程中更加敏感的与疗效相关的数量改变以及驱动基因检测与组织标本的高度一致性。但该研究仍旧是一个小样本研究, CellCollector® 在CTC分选中的优势尚需前瞻性大样本研究证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|