| 胡毅教授, 博士研究生导师, 中国人民解放军总医院肿瘤内一科行政主任。获评解放军总医院首届“ 临床优秀医师” 、首届“ 百位名医” 、“ 百病妙诀” 承担人、教学先进个人。担任北京市乳腺病防治学会肿瘤免疫治疗专业委员会主任委员; 中国研究型医院学会肿瘤学专业委员会副主任委员; 担任中国临床肿瘤学会青年委员会副主任委员, 肺癌组组长; 全军医学科技委员会肿瘤专业委员会常委; 中华医学会肿瘤学分会青年委员; 全国医师定期考核肿瘤专业编辑委员会委员, 担任《国际肿瘤学杂志》、《中华实用医学杂志》等多本杂志的编委及审稿专家。以第一承担人承担国家自然科学基金2项, 省部级课题10余项, 第二承担人参与包括国家863重大课题2项, 累计科研经费400余万元。第一完成人获多项成果奖, 发表50余篇专业文章, 发表SCI文章30余篇。指导及参与指导博士研究生5名、硕士研究生20余名。 |
研究一:Cheng H, Zou Y, Ross JS, et al. RICTOR amplification defines a novel subset of patients with lung cancer who may benefit from treatment with mTORC1/2 inhibitors[J]. Cancer Discov, 2015, 5(12): 1262-1270.
研究二:Paik PK, Shen R, Won H, et al. Next-generation sequencing of stage Ⅳ squamous cell lung cancers reveals an association of PI3K aberrations and evidence of clonal heterogeneity in patients with brain metastases[J]. Cancer Discov, 2015, 5(6): 610-621.
2b。
研究一:靶向治疗在肺癌中取得了重大进展, 但仍有接近一半的肺腺癌患者未能确定常规治疗靶点的基因改变, 有学者通过二代测序技术在一位年轻肺腺癌患者发现仅有RICTOR扩增。RICTOR是mTOR复合体2(mTORC2)的重要组成成分, mTORC2在多个癌种的调控肿瘤细胞迁移、浸润和转移中发挥了重要作用, 但是RICTOR扩增在人群中的发生率、是否为致瘤基因以及对药物的敏感性等问题有待阐明。
研究二:肺鳞癌的治疗一直缺乏突破性的进展, 当前对肺鳞癌的分子遗传学分析多基于早期肺鳞癌患者的手术标本, 而Ⅳ 期肺鳞癌患者的基因谱数据较为局限。前期研究发现, FGFR1扩增以及过度激活的PI3K通路改变是肺鳞癌的主要致癌基因和药物靶点, 但是具有这些基因改变的Ⅳ 期肺鳞癌患者的总生存情况和转移形式不明确。
研究一:探究RICTOR扩增在肺癌中的发生率, 验证RICTOR通路的致瘤作用以及mTORC1/2抑制剂敏感性和RICTOR扩增的关系。
研究二:探究晚期肺鳞癌致癌驱动基因以及生物学基础的差异, 明确具有FGFR1扩增和PI3K变异的两种人群的总生存情况和转移形式的差别。
研究一:
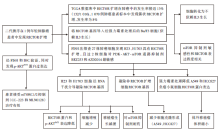
• 研究条件:美国叶史瓦大学肿瘤内科、分子遗传学遗传病理部、病理科, 中国广州中山大学肿瘤医院, 纽约大学兰贡医学中心肿瘤内科, 美国马萨诸塞州坎布里奇基础医学公司等参与。
• 研究对象:1名具有RICTOR扩增的晚期肺癌患者, 1 070例来自不同病理类型肺癌患者标本, 27株肺癌细胞系, 小鼠Ba/F3工具细胞等。
• 研究方法:研究流程及结果见图1。
研究二:
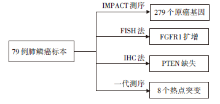
• 研究条件:美国纪念斯隆凯特琳癌症中心胸部肿瘤科、病理科、流行病和生物统计学中心, 人类肿瘤发病机制中心, 威尔康乃尔医学院。
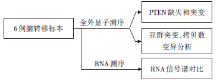
• 研究对象:79例Ⅳ 期肺鳞癌患者标本, 6例脑转移患者手术切除冰冻标本(其中4例具有原发肺部病灶石蜡标本)。
研究一:结果见图1。
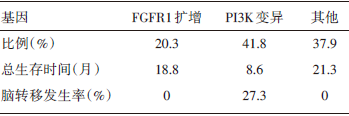
研究二:不同基因型的突变比例, 总生存和脑转移发生率见表1。
| 表1 不同基因型的突变比例、总生存和脑转移发生率 |
(1) 4/6例脑转移病灶和原发灶同时表达PTEN缺失, 且原发和转移灶之间没有差异; 脑转移病灶的PTEN变异谱与TCGA数据库早期患者RNA谱相比具有明显差异(P=0.003)。
(2) 2名患者的配对肺和脑转移标本的全外显子组测序表明, 肺原发灶和脑转移灶共有的非同义突变比例很低, 仅为15%和26%, 且瘤内异质性程度高, 拷贝数变异程度也各异。
(3) 与其他基因改变相比, 具有PI3K变异的Ⅳ 期肺鳞癌患者肿瘤负荷高且易发脑转移(大于3个器官转移的比率为18% vs. 3%, P=0.025), 但并未发现WNT信号通路上调和Serpin蛋白过表达和肺鳞癌脑转移相关。
• 研究一:RICTOR扩增具有调节肿瘤细胞的生存和增殖的致瘤作用, 在肺癌患者中的发生率为8%~13%, 同时mTORC1/2抑制剂可抑制RICTOR扩增的肿瘤细胞生长。
• 研究二:晚期肺鳞癌患者FGFR1扩增和PI3K变异的频率和早期患者类似, 具有PI3K通路上游变异的患者预后较差, 更易发生脑转移, 同时原发灶和转移灶之间亚克隆突变和拷贝数差异大。
精准医学时代的到来不仅改变了传统肿瘤治疗的理念, 也改变了药物研发的历程。在第一代EGFR-TKI时代, 药物的研发还是“ 正向开发” , 即首先出现了第一代EGFR-TKI, 并经历了多个临床研究的失败, 最终通过优势人群明确了获益人群为特定的外显子突变人群, 而随后的ALK抑制剂、三代EGFR-TKI等都是通过明确的治疗靶点, 再进行了药物研发和临床研究, 显然大大加速了药物研发的进程。
近期由Cheng等发表的《RICTOR amplification defines a novel subset of patients with lung cancer who may benefit from treatment with mTORC1/2 inhibitors》研究, 就是典型的通过已知的基因突变来寻找潜在的可治疗的靶点。mTOR作为细胞信号传递的中间分子, 在信号传导中起着十分重要的作用。它包括了mTORC1和mTORC2两个复合物, 其中mTORC2的下游通路仍有许多未知。RICTOR作为mTORC2复合物的一部分, 在该信号通路上起到关键作用。该研究通过体内和体外研究证实了RICTOR可能是非小细胞肺癌的驱动基因, RICTOR基因扩增可能是mTOR1/2抑制剂的疗效预测标志物, 从基础研究层面来说是一个较完整的研究, 同时临床个案也证实了可能的临床获益。RICTOR在非小细胞肺癌中10%的突变频率提示该驱动基因并非存在于一个很小众的人群, 特别是在驱动基因研究举步维艰的肺鳞癌及小细胞肺癌中仍存在15%左右突变, 这对于肺鳞癌及小细胞肺癌患者来说是个不错的消息。
但是作为临床前的探索性研究, 后续还有很多工作要做。首先, 虽然驱动基因尚无准确的定义, 但现在比较公认的看法是针对驱动基因的治疗可以达到50%以上的缓解率和6个月以上的无进展生存期时, 这个驱动基因才可以算有临床实践意义, RICTOR的扩增能否达到这个要求还需要更多的临床数据。其次, 在本研究中RICTOR的扩增以及表达都能作为mTORC1/2抑制剂临床疗效的标志物, 这样的靶向显然不够“ 精确” , RICTOR的扩增以及表达都提示mTOR通路的激活, 是否还有其它潜在的分子标志物仍需更多的研究证实。虽然近年来在肺腺癌驱动基因的靶向治疗上进展迅速, 但是在肺鳞癌上针对驱动基因的靶向治疗仍未取得突破, 二代测序技术在临床的广泛应用极大地加快了临床分子病理研究的进展, 也有机会让我们更深入地理解肿瘤的分子机制。
《Next-generation sequencing of stage Ⅳ squamous cell lung cancers reveals an association of PI3K aberrations and evidence of clonal heterogeneity in patients with brain metastases》研究是第一个针对晚期肺鳞癌的较全面和系统的分子病理研究, 同时很好地与患者临床及预后特征相互联系。虽然该研究的样本量不大, 但是显示出近乎“ 全或无” 的差异, PI3K的激活是绝对的预后不良因素, 与未激活组比较总生存期的风险比达到5.6。PI3K激活的患者脑转移的发生率为27%, 而PI3K未激活组转移率为0, 同时PI3K激活组也有更高的肿瘤转移负荷, 这些数据很好地指向了PI3K信号通路, 该信号通路在肺鳞癌的发展过程中起到关键性的作用, 是后续鳞癌靶向治疗研究的突破点。
该研究中定义PI3K的激活包括PIK3CA、PTEN的突变以及PTEN的缺失, 目前靶向治疗上成功的药物都是针对特定基因的改变, 针对宽泛的信号通路激活的治疗仍未取得成功, 包括本研究中PI3K信号通路激活的患者针对PI3Kα 抑制的治疗也缺乏反应, 鉴于样本量的限制, 在后续的研究中应进一步的细化和深入, 将PI3K的激活明确为特定基因的改变, 才能真正达到“ 靶向” 。
肿瘤异质性是导致肿瘤治疗失败的重要原因, 该研究通过原发灶、转移灶的基因分析进一步地阐释了肿瘤异质性的存在, 原发灶和转移灶的基因改变中只有15%的同源性, 这也提醒我们临床的组织标本检测可能不能完全反应肿瘤的实际情况, 血液ctDNA的检测具有更好的均质性, 值得更多地研究。
The authors have declared that no competing interests exist.