61岁非吸烟女性患者, 因“ 体检发现右下肺肿物10天” 入院。患者于2015-06-01体检时胸片示右下肺后基底段结节影, 考虑周围型肺癌可能性大; 2015-06-09行胸腹部CT检查示右肺下叶外侧底段一分叶状24 mm× 22 mm肿块, 病灶形态不规则, 增强扫描后边缘明显强化。左侧肾上腺可见一直径约6 mm结节影, 增强扫描后轻度强化。其余部位未见异常。右肺下叶外侧底段结节影, 考虑肺癌可能性大, 左侧肾上腺结节影, 需进行腺瘤和增生鉴别。为进一步诊治收住我科。
既往史:高血压病史5年, 血压最高约170/100 mmHg, 未行规律治疗; 无冠心病史; 无心肌梗死病史; 无慢支肺气肿病史; 无结核病史。体重无明显下降。
个人史、月经史、家族史无特殊。
查体:T:36.5℃, P:72次/分, R:20次/分, Bp:138/79 mmHg, PS评分1分。未扪及浅表肿大淋巴结。
辅助检查:NSE 21.19 ng/mL, 非小细胞肺癌抗原37.74 ng/mL, CEA、CA199正常。
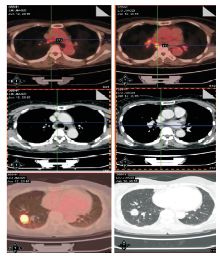
2015-06-12 PET/CT:右肺下叶结节, 大小约2.1 cm× 2.4 cm× 2.1 cm, SUVmax10.3, 区域多发肿大淋巴结(4R、7、10R、11-14R)糖代谢不同程度增高, 考虑右肺癌并区域淋巴结转移, 见图1。
诊断及治疗过程:
2015-06-16 行经颈纵隔镜检查术。
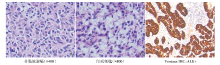
病理诊断:淋巴结转移性腺癌(10/12; 其中隆突下LN 5/7, 右下气管旁LN 5/5); 瘤细胞胞浆红染, 部分呈印戒状。见图2。
基因检测:ALK基因断裂78% ALK(IHC)(+), EGFR基因突变(-), ROS1(-), cMET(-), PIK3CA 4项(-)。
诊断:右下肺印戒细胞腺癌 cT1bpN2M0 Ⅲ A期(ALK+)。
治疗:克唑替尼靶向新辅助治疗28天, 疗效评价部分缓解。2015-08-06拟行右下肺叶切除术+肺门纵隔淋巴结清扫术; 术中由于叶间淋巴结与中叶动脉粘连, 难以分离, 决定行中下肺叶切除术+肺门纵隔淋巴结清扫术。
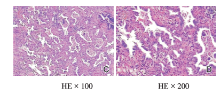
术后病理诊断:右下肺浸润性腺癌, Ⅱ 级(淋巴结转移共3/20; 其中“ 中叶LN” 1/1; “ 右下气管旁LN” 1/2; “ 隆突下LN” 1/4)。见图3。
董嵩(肿瘤外科学主治医师)、聂强(肿瘤外科学副主任医师):汇报病史特点(略)。提出讨论要点:进一步的抗肿瘤治疗方式的选择。
钟文昭(肿瘤外科学教授):Ⅲ A N2非小细胞肺癌一直是内科、外科、放疗科、病理科等关注的重点, 其治疗方式也颇具争议性。Ⅲ A N2的争议性很大程度在于N2广泛的异质性, 单站、多站、Discrete、Bulky等预后差异较大。不同的指南对Ⅲ A期分类更是迥异。最近在Journal of Thoracic Oncology上发表的关于第八版TNM分期N的预案, 已准备把N2分成了3个亚组, 即, 单站N2, 不伴N1淋巴结受累的跳跃性转移的N2a1; 伴N1淋巴结受累的N2a2; 以及多站N2淋巴结受累的N2b。分析显示N2不同组别生存曲线完美分离, 说明淋巴结受累程度与预后密切相关。Robinson Classification将Ⅲ A期从微观术后病理发现的N2到宏观影像可见N2分为Ⅲ A1、Ⅲ A2、Ⅲ A3、Ⅲ A4。2013年ACCP(American College of Chest Physicians)指南将Ⅲ AN2分成外侵团块型、非融合型和偶然性N2。2015 ESMO(Europe Society for Medical Oncology)将Ⅲ AN2分成偶然发现的N2、潜在可切除和不可切除的N2。由于Ⅲ A N2本身的异质性导致了不管是在前瞻性临床研究还是在回顾性数据分析均难以得到较一致的最优治疗方式的结论。故Ⅲ AN2从诊断、治疗到预后都是异质性较明显的一个群体, 需要化疗、放疗、手术等多学科综合治疗。目前Ⅲ A N2患者的治疗基于三种治疗方式的组合模式各异, 并没有一个统一的治疗标准。术后放疗的争议也非常大, 需要更高证据级别的前瞻性临床研究来证实。目前靶向治疗应用于Ⅳ 期肺癌患者获得良好疗效, 那么能否将靶向药物用于局部晚期Ⅲ A N2患者的治疗呢?目前还缺乏有力的证据。对于不可切除的Ⅲ A N2期患者的治疗, 放化疗是大家公认的治疗模式。对于偶然性的N2, 治疗模式通常是手术+辅助化疗。目前争议最大的就是对于潜在可切除N2患者治疗方式的选择, ACCP指南建议进行多学科Team Board讨论后决定治疗方式。
颜黎栩(病理科医师):从病理学图像看, 患者的肿瘤内有两种细胞形态的腺癌, 图2A为典型的腺癌, 细胞核较正常肺泡上皮大, 核深染, 偏位, 胞浆粉染。图2B(取自转移淋巴结)胞浆黏液蓝染, 将细胞核挤向一侧, 成印戒样改变, 为少见的肺癌组织学亚型。
杨衿记(肿瘤内科学教授):印戒细胞癌中ALK基因突变比例是多少?
颜黎栩:目前还没有这方面的数据, ALK突变少见, 在《Lung Cancer》等报道的发生率为低于5%。黏液细胞癌ALK基因突变的比例比其他类型腺癌要高出很多。
钟文昭:目前对于Ⅲ AN2肺癌, ALK阳性、潜在可切除患者的治疗方式有四种, 即新辅助化疗、新辅助放化疗、同步放化疗、新辅助靶向治疗。
杨衿记:“ 潜在可切除” 的概念是怎样的?
钟文昭:不同指南对Ⅲ A N2的分类大同小异, 但是目前还没有明确的关于“ 潜在可切除” 的定义, 主要依靠外科医生的经验评估。
杨衿记:外科医生判断“ 潜在可切除” 的标准是什么?
钟文昭:可切除和不可切除之间的界限仍是模糊的, 按ESMO指南, “ 潜在可切除” 是指潜在可切除但是存在不可切除的风险。
杨学宁(肿瘤外科学教授):潜在可切除涉及到术中完整切除性, 和预后相关。上世纪60年代的医生普遍认为手术对N2患者的生存期改善不明显, 甚至欧洲某些医生也认为N2为不可切除, 但是当时的诊断是基于一般体层摄影, 能够通过影像看到的N2基本都属于Bulky N2, 一般都为不可切除。随着诊断技术及诊断水平的不断提高, 我们能够发现越来越小的病灶, 对于某些潜在可切除的病灶, 我们也许能完整切除。我个人认为“ 潜在可切除” 可能指我们术中不能完整切除, 或者多站N2转移。
旁述:Bulky的概念是指淋巴结短径> 2 cm, 经细胞或组织学病理证实为阳性的淋巴结, 淋巴结包膜外侵。上述病例诊断应为Ⅲ A3 , 纵隔镜检查术提示7组淋巴结转移。
杨衿记:从手术可切除率来讨论潜在可切除N2, 手术与传统放化疗相比较是否无病生存期、无进展生存期更有优势?如果不存在优势, 那么我们将不会考虑以手术方式来治疗不可切除的N2。
杨学宁:如果手术和化放疗效果相似, 我们需要考虑两者分别的优势。目前手术死亡率约3%, 化放疗的死亡率在3%以下, 死亡风险并不会较放化疗高, 而且手术是当前肿瘤治疗价格比较低廉的方式。
李伟雄(放射治疗学教授):INT0139研究已经解释了这个问题, 新辅助放化疗+手术对比新辅助化疗+手术, 亚组分析的结论为病灶较小(单站)能够肺叶切除患者的生存率会比放化疗高以外, 全肺切除患者的生存率低于放疗组。
旁述:2009年8月1日发表在《Lancet》上的文章“ Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small cell lung cancer” , 即INT0139的Ⅲ 期临床研究的结果。该研究的主要研究方向为:①评估同步放化疗+手术是否比单纯的同步放化疗在提高患者生存期上更有优势; ②评估两组患者的不良反应; ③观察原位复发和远处转移的模式。主要终点是总生存期。研究结果显示手术只能提高患者无进展生存期, 对总生存期无改善。但是亚组分析显示手术对肺叶切除患者的总生存期有提高。
杨学宁:对于全肺切除的患者, 尤其是右肺全切的患者, 术后行同期放化疗, 其死亡率为10%~15%, 所占比例很高, 很多患者将不会选择。
周海榆(胸外科副主任医师):建议将单站N2淋巴结定义为潜在可切除; 如果出现2站或者多站N2将不视为潜在可切除。ESMO及美国相关指南, 都更倾向于将单站定义为潜在可切除。
钟文昭:目前的指南都没有Ⅲ A N2单站淋巴结转移的概念, 你提出潜在可切除单站淋巴结转移有何循证医学证据?
杨学宁:单站N2目前没有循证医学证据。“ 潜在可切除” 其实一直到现在都是一个很模糊的概念, 如果强行定义, 其在临床上的运用度又将如何?这将是一个问题。
李伟雄:在第八版TNM分期预案中, N1b(多站N1)和N2a(单站N2, 伴或不伴N1淋巴结受侵), 患者生存曲线重叠, 意味着单纯以N2的站数来预测患者的预后并不可靠。
钟文昭:该分期依据的数据全部来自手术患者, 手术多站N2患者的预后比手术单站N2患者的预后要差, 放疗多站N2患者的预后比手术单站N2患者的预后要差, 但是手术的单站与放疗的单站、手术的多站与放疗的多站相比较的证据还没有。近年来各种指南和临床试验越来越多的证据重新调整了对手术的地位, 原Ⅲ AN2的患者一般直接行化放疗治疗。
杨学宁:Ⅲ A N2患者的治疗从非手术的放化疗到手术结合放化疗的治疗模式的演变, 其初衷与归宿是一致的— — 提高患者生存率, 其治疗模式是选择手术或者放化疗, 或者是两者结合起来, 有待进一步的探究。
钟文昭:在Ⅲ AN2的治疗上主张放疗仍是主流。
谢松喜(放疗科副主任医师):2012年美国胸外科学会进行了一项调查, 从放疗科角度解析“ N2非小细胞肺癌术前和术后放化疗价值” , 共513位外科医生回答了问卷:84%外科医生认为镜下转移的N2可以选择诱导化疗+手术。62%外科医生认为临床可见(影像及体格检查)的N2行诱导治疗后如果有降期可以手术。对于巨块型的单站N2患者, 32%认为诱导治疗后如果降期可以行肺叶切除; 30%认为可行全肺切除; 12%认为不论是否降期都手术; 22%认为行同步放化疗。如果肺功能不可耐受全肺切除, 50%认为诱导治疗后行手术; 41%认为行同步放化疗。NCCN指南对于非侵袭性N2, 将同步放化疗列为1类证据, 而诱导化疗(加或者不加放疗)后疾病无进展者行手术治疗, 术后辅以放化疗的证据级别为2B。在手术完全切除的偶然发现的N2(Ⅲ A1、Ⅲ A2)患者在化疗结束后可行45~54 Gy剂量的术后放化疗是适宜的。我们中心很少做术后放疗。根据2015年发表在美国临床肿瘤学杂志上的对N2 非小细胞肺癌诱导和辅助治疗的标准(美国放射学会), 临床可见N2需进一步确认, Ⅲ A3患者可行肺叶切除者有三种选择:化疗+术后放射治疗(60~70 Gy), 化疗+术后放疗(45~54 Gy), 诱导化疗后手术, 术后根据实际情况决定是否行放疗均可。对于手术需行全肺切除Ⅲ A3患者行同步放化疗(60~70 Gy)是最佳治疗方式, 一些专家可能会选择诱导放化疗后手术治疗, 术后选择性行放射治疗。术前术后的放疗都建议行现代放疗技术, 即3-DCRT(三维适形放疗)和IMRT(调强放疗)。
最新发表在JCO上的ASCO对局部晚期非小细胞肺癌辅助放疗的指南, 对局部晚期非小细胞肺癌治愈性目的的治疗, 同步放化疗在局部控制率及总生存方面较序贯化放疗更优。RTOG 0617研究结果表明60 Gy的放疗剂量是最合适的, 在传统分割方式的基础上增加放疗剂量不能增加患者获益。目前在肺癌治疗领域较少在化疗前行诱导治疗。2015年ASCO上公布的一项研究结论表明, 体积大于45 cc、N3、放疗照射野有困难者可考虑诱导化疗后行同步放化疗。对于非足量化疗剂量同步化疗+放疗的患者建议行巩固化疗。目前理想的同期放化疗中化疗方案的选择还没有定论, 最常用的化疗方案EP(依托泊苷+顺铂)和PC(紫杉醇+卡铂), 一般患者对PC的耐受性较EP好。基于美国退伍军人医院的研究结果, PC方案可能对男性鳞癌患者的疗效更好。对于不能耐受同步放化疗者, 建议行序贯化疗后放疗, 因为序贯化放疗较单独放疗对患者总生存期的改善更明显, 并且有效地降低了不良事件的发生率。对于手术完全切除的N2患者, 为了降低原位复发率, 也推荐行放射治疗。如术后行化疗, 放疗应该在化疗完成后进行, 主要是为了减少毒副反应, 且放疗剂量一般不超过54 Gy。对于不完全切除(R1、R2)患者术后应辅以同步或者序贯化放疗。对于可切除的Ⅲ 期非小细胞肺癌患者应行多学科综合管理, 对于无体重下降、女性、单站淋巴结受累患者推荐行术前放化疗等多学科综合治疗。
目前还没有一个大、中样本量术后放疗随机对照研究数据发表, 2015年JCO上发表的“ Postoperative radiotherapy for pathologic N2 non-small-cell lung cancer treated with adjuvant chemotherapy:A review of the National Cancer Data Base” , 该研究是真实世界的反映, 病理证实为N2患者, 术后辅以放疗组和术后无放疗组患者的中位总生存期分别是45.2个月和40.7个月, 5年总生存率分别是39%和34.8%, 虽然差异没有统计学意义, 但在某种程度上反映了术后放疗对患者总生存率有一定的提高。
基于以上研究结果, 回归到我们刚才讨论的问题, 对于偶然发现的N2, 我们放疗科建议行化放疗治疗, 但是这类患者术后行放疗的数目很少。对于临床可见即Ⅲ A3的患者, 在进行外科、内科、放疗科等多学科综合讨论后考虑肺叶切除N2患者, 建议选择无体重下降、女性、单站淋巴结受累患者行新辅助化疗后手术、术后辅以放疗, 同步放化疗后手术, 或者行全量同步放化疗, 至于哪种治疗方式更优, 目前许多临床研究正在做头对头的比较, 例如2015年SAKK肺癌研究组发表的Ⅲ 期临床研究结果表明, 化疗+放疗+手术与单纯化疗+手术对比无事件生存期无改善, 故对可切除Ⅲ AN2新辅助治疗单纯化疗均可, 无需加放疗。基于INT0139研究对于考虑行全肺切除或者不完全切除者考虑行全量同步放化疗或者化疗+放疗+手术, 这很大程度上取决于医生的个体化选择。
旁述:2015年4月发表在《American Journal of Clinical Oncology》上的“ ACR appropriateness criterias induction and adjuvant therapy for N2 non-small-cell lung cancer” , 经过多学科专家团体的讨论提出了Ⅲ A N2患者较合理的治疗方式。对于可切除的Ⅲ A1和Ⅲ A2患者建议术后行辅助化疗(含顺铂), 由于目前还没有明确术后放化疗可提高患者总生存率, 故根据实际情况选择性行术后放疗; 对于Ⅲ A3患者, 治疗可考虑:(1)根治性化放疗+/-辅助化疗; (2)诱导化放疗+手术+/-辅助化疗; (3)诱导化疗+手术+/-术后放化疗; Ⅲ A4为不可切除, 直接行同步放化疗。
2015年SAKK肺癌研究组发表的“ Induction chemoradiation in stage Ⅲ AN2 non-small-cell lung cancer: A phase 3 randomised trial” , 该研究将评估为可切除Ⅲ A N2患者随机分配到新辅助放化疗组和新辅助化疗组, 两组的中位无事件生存期(首要研究终点指标)分别是12.8个月和11.6个月, P=0.67, 差异无统计学意义。但是两组的中位总生存期分别为37.1 个月和 26.2个月, 相差约12个月。
周清(肿瘤内科学教授):前面讲的循证证据及研究结果都是差异没有统计学意义, 可为什么手术患者最后的结论是同步放化疗优于化疗?
李伟雄:诱导化疗+手术与诱导放化疗+手术比较, 证据显示加上放疗后其首要终点指标无事件生存期改善不明显, 故现在不建议术前辅助放疗; 诱导化放疗+手术对比化疗+手术的总生存期有提高, 循证医学证据表明虽然有改善(约12个月), 但是Ⅲ AN2患者复发的主要模式是远处转移, 总生存期受进展后治疗的影响大, 故术前也不建议行诱导放射治疗。INT0139研究表明同步放化疗后行手术治疗对患者总生存期无改善。我也并不主张同步放化疗+手术治疗, 因为同步放化疗+手术的毒副作用对患者是一个很大的考验, 其术后死亡率更高。
谢松喜:序贯放化疗是没有必要, 化疗+手术, 术后根据情况考虑行放疗。生存期优于诱导同步放化疗+手术和全量同步放化疗。
杨学宁:患者的异质性很大, 且每个医生经验迥异, 因此会选择不同治疗模式。外科医生和内科医生对患者的期待值不同, 可以选择不同的治疗模式, 比较不同治疗方式的优劣, 实现对现有模式的突破。
钟文昭:对于Ⅲ A N2患者的治疗分三个阶段, 即术前、术中、术后阶段, 所有的临床研究都是基于某个特定的阶段或者某个点, 从全程管理角度把握治疗全局, 如术前化疗、手术、术后行放疗, 前后衔接精密。手术、放疗、化疗三种治疗手段组成了对N2患者四种不同的治疗模式:化疗+手术± 术后放化疗、全量同步放化疗、诱导同步放化疗+手术、化疗+放疗+手术, 而这四种治疗模式的争论焦点在— — 手术和放疗, 即同步放化疗后是否应行手术治疗?新辅助治疗(化疗+/-放疗)+手术患者术前是否应行新辅助放疗?化疗作为全身治疗方式, 无论在哪种治疗模式中必不可少。所谓的Team Board就是内科医生、外科医生、放疗科医生多学科一起共同决策患者的治疗方式。INT0139 的研究结论就是观察点在于“ 手术是否有用” , 同步放化疗后手术组对比同步放化疗组, 手术对无进展生存期有改善, 但是总生存期无提高, 继续亚组分析显示肺叶切除患者的总生存期有改善, 全肺切除患者无明显改善。对我们临床指导就是如果患者术前评估为肺叶切除, 那么我们按照同步放化疗+手术的方案。一旦术前评估为需行全肺切除, 那么患者将不接受手术治疗。2015年SAKK发表在《Lancet》上的“ Induction chemoradiatherapy in stage Ⅲ A/N2 non-small-cell lung cancer:A phase 3 ramdomised trial ” 中, 23个研究中心入组232例可手术患者, 随机分成新辅助化放疗组和单纯化疗组, 研究结果表明新辅助放疗的患者无获益, 对于Ⅲ A N2患者术前新辅助化疗即可。就其生存曲线来看, 中位无事件生存期和总生存期都有数值上的提高, 但是差异没有统计学意义。Ⅲ A N2异质性明显, 其治疗模式有待进一步探究, CTONG1103就是其中之一, 但入组患者困难, 5年时间仅入组50余例患者。
该患者为女性、非吸烟患者, 临床诊断为右下肺癌 cT1bN2M0 Ⅲ A期, 准备入组CTONG1103研究, 基因检测提示:EGFR野生型, ALK基因有78%断裂, 患者通过各种途径了解靶向治疗后, 患者拒绝新辅助化疗, 故在充分知情同意后行具有争议性的克唑替尼靶向新辅助治疗。
聂强:患者服用克唑替尼28天后复查PET/CT, 总体疗效部分缓解(缩小58.3%), 原发病灶在大小、SUVmax、淋巴结SUVmax都有所下降, 重新分期为右下肺癌 yT1aN0M0Ⅰ A期。
陈华军(肺一科副主任医师):SAKK研究比较的是新辅助化疗后临床降期与非降期患者的生存曲线, 但是目前靶向治疗主要用于晚期肺癌的治疗, 约2%~3%患者最佳疗效可达完全缓解, 尽管病灶有缩小甚至消失, 但是原病灶部位仍有一定量的肿瘤细胞残存, 新辅助靶向治疗后降期的意义有多大, 有待进一步研究的确认。
聂强:按现有指南, 一般患者在治疗1个月左右需复查评价疗效。晚期患者治疗后疗效评价时间一般为6周。
杨衿记:中位起效时间为2周, 主要观察症状缓解所需时间。
聂强:评价后拟行右下肺叶切除术+肺门纵隔淋巴结清扫术, 术中我们发现患者叶间淋巴结与中叶动脉粘连, 难以分离, 决定行中下肺叶切除术+肺门纵隔淋巴结清扫术。术后病理提示:右下肺浸润性腺癌, Ⅱ 级; 淋巴结转移共3/20。新辅助治疗前后FISH检测ALK基因断裂分别为78%和63%。
董忠谊(肿瘤学博士):吴一龙教授提出了肿瘤的时空异质性, 我们对比了患者术前纵隔镜病理及术后病理, 我们发现原发肿瘤PDL1表达(-), ALK表达(+), 隆突下下叶淋巴结PDL1表达(-), ALK表达(+), 淋巴结PDL1表达(+), ALK表达(-), 中叶淋巴结PDL1表达(-), ALK表达(-), 肿瘤异质性明显。PDL1表达在空间表达上存在相当大的异质性, 其在肿瘤和淋巴结均有表达, 但是其在肿瘤间质细胞的表达率高于肿瘤实质细胞。目前的研究表明PDL1的表达与许多癌基因信号通路有关, 其中ALK癌基因可以诱导PDL1的表达, 已有发表文献表明PDL1癌基因ALK融合中PDL1的表达较高, 用ALK-TKI后ALK表达程度有所下降, 甚至为阴性。基因表达时间异质性, 即治疗诱导的异质性, 研究表明化疗、放疗、TKI治疗后, 人体内T细胞活化后可分泌干扰素λ , 而干扰素λ 可以诱导PDL1的表达, 伴随着治疗的进行PDL1应会呈进行性升高。但遗憾的是术后由于患者原发病灶及淋巴结内肿瘤细胞的减少, 不能再次检测PDL1的表达来进行ALK-TKI治疗前后对比来验证我们的想法。
钟文昭:以上即基因表达的时空异质性, PDL1和ALK均存在时空异质性, 以上检测病灶均为有肿瘤细胞存在的病灶, 但是ALK和PDL1的表达有阳性和阴性, 那么基于以上检测结果我们有了下一步的治疗依据, 需考虑加入术后辅助化疗。
李伟雄:2007年后临床研究新辅助后行放疗对无进展生存期和总生存期均无改善, 故不建议行放疗。
周海瑜:ALK-TKI服用时间为什么选择1个月, 其依据来源?虽然1个月后复查PET降期, 但是患者有必要再服用1个月或者2个月吗?新辅助治疗达到什么目的就考虑手术?术后进一步治疗方式如何选择?
陈华军:ALK-TKI服用多长时间后行手术治疗, 目前还没有这方面的数据, 但是EGFR-TKI(发表在2014年Lung Cancer)病灶在1个月都会明显缩小, 1~3个月病灶会进一步缩小, 超过3个月病灶达到稳定状态。
钟文昭:目前为止, TKI靶向药物用于新辅助治疗已公布结果的是2008年发表于JCO上, TKI使用时间为1个月。新辅助治疗降期后可考虑手术治疗。现在靶向应用于局部晚期暂无证据, 故术后行化疗。至于术后是否行放疗, 众论不一。SAKK研究强调对手术质量的严格控制, 除了传统淋巴结清扫要求3站N1、3站N2外, 要求对于不用肺叶需做自定义相应区域淋巴结清扫, 引入除R0、R1、R2之外的另外一个概念, 即R uncertain, 包括:①未清扫规定区域淋巴结; ②淋巴结清扫过程中出现破裂; ③最高纵隔淋巴结受侵; ④淋巴结包膜外侵。该患者手术应该属于R uncertain, 故术后治疗会采用化疗+放疗。有一点需要明确, 患者如果再次使用克唑替尼, 那么需服用多长时间?
周海瑜:术前明确2站N2(+), 如进一步探索看可考虑继续行克唑替尼治疗, 或者行化疗, 或者化疗后进一步 ALK-TKI治疗, 暂不考虑放疗。
杨衿记:目前术后治疗证据较多的就是术后化疗, 术后ALK-TKI靶向新辅助证据甚少, 故比较适当的辅助治疗方式即术后化疗。纵隔淋巴结切除既然为uncertain, 那么暂不考虑行局部放疗。
廖日强(肿瘤外科学主治医师):我认为R uncertain为术中淋巴结分块切除, 故同意钟主任的意见, 建议术后4周期化疗后行放射治疗。
周海瑜:那么对于术中uncertain淋巴结, 术后病理验证是否为转移性淋巴结, 术中uncertain淋巴结部位是否有标记?这个问题值得我们外科医生进一步思考。其实有ALK基因突变的患者预后相对较差, 但是幸运的是存在相应的靶向治疗药物, 我们应该将所有的可用手段在不同的时期全部用上。为进一步探索, 是否应该在下一步治疗时加入ALK-TKI?王长利教授的临床试验中, 患者服用TKI (厄洛替尼)1年半后无病生存期延长, 总生存期有待进一步的结果。以此类推, ALK-TKI长时间服用是否也能有生存获益呢?我们不得而知。该病例在初治时是探索一种新的治疗方式, 那么术后为什么行标准化疗而不进一步考虑行ALK-TKI治疗?如果单纯因术前纵隔镜检查术造成了术后淋巴结切除的不确定性, 那么加入放疗的意义有多大?因此不建议行放射治疗。Ⅲ A N2患者术后必定会复发, 待复发后再加上包括放疗在内的其他治疗也是可行的, 不必操之过急进行术后放疗。
杨学宁:该患者在术前治疗时要求行靶向治疗, 但目前靶向新辅助治疗的证据很少, 于是充分知情同意后行该治疗。该例患者手术切除为uncertain, 那么是否我们应该考虑对于纵隔镜确诊N2的患者是否在纵隔镜检查术后直接行纵隔淋巴结清扫, 避免纵隔镜后再手术患者纵隔淋巴结切除的不确定性。目前还没有靶向和放疗联合治疗Ⅲ AN2患者的证据, 为达到治愈性目的, 术后放疗必不可少。在晚期患者, 靶向治疗较化疗的中位无进展生存期延长近1倍, 那么新辅助术后患者是否应该应用ALK-TKI, 印戒细胞癌对化疗效果并不是特别好, 化疗疗效值得质疑。化疗联合ALK-TKI有太多未知有待进一步解答。
现阶段AKL-TKI在晚期患者中应用的证据尚不多的情况下将ALK-TKI应用于Ⅲ A N2患者的新辅助治疗更缺乏有力的证据。任何药物的广泛应用必须经过Ⅳ 期临床试验充分评估, 虽然随着精准医学的兴起将靶向治疗推向了一个全新的高度, 但是还没有在不同分期患者中经过大量临床试验探究, 靶向药物的应用对患者生存的影响仍是一个未知数。我们对不同药物、不同治疗模式的探索, 目的是努力提高患者的生存期和生活质量, 所以我们有了在充分知情同意情况下进行的大量的临床试验。现有的指南就是对既往最佳治疗方式的汇总, 一般情况下应该按照目前最佳治疗方式来医治患者, 但是治疗过程是双向的, 患者必须配合医生的治疗。一旦患者拒绝标准治疗, 选择其他非标准治疗方式时, 医者应充分告知患者可能的影响及预后, 必要时报备伦理。我们鼓励探索的精神, 可是我们也要预知患者更长的生存期和更高的生活质量, 治疗模式的改良或者改革需要的不是个案, 患者也应该对自己负责任, 尽可能减少非标准治疗个案的发生。
The authors have declared that no competing interests exist.