| 朱广迎, 北京大学肿瘤医院放疗科主任、医学博士、教授、主任医师、博士研究生导师。专业特长:擅长利用精确放疗和综合治疗根治肺癌等常见恶性肿瘤。兼任北京抗癌协会放疗分会主任委员、中国抗癌协会放疗专业委员会常委、中国医师协会肿瘤放疗医师分会副会长、北京医学会放疗分会副主任委员、中国抗癌协会肺癌专业委员会委员、中国临床肿瘤协会执行委员、中华肿瘤学分会委员、国家自然科学基金评委、中华医学科技奖评委及多个机构委员、国际放射原子能机构立体定向放疗项目中国专员。任《中华放射肿瘤学杂志》、《中国肺癌杂志》、《癌症》、《中国癌症研究》、《中德临床肿瘤杂志》、《中国神经肿瘤杂志》、《Chinese Journal of Cancer Research》等多本中英文肿瘤杂志编委, 英国《Expert Opinion on Pharmacotherapy》审稿人, 《全球肿瘤时讯》特约编委、《生命时报肿瘤版》高级顾问。主持国家自然科学基金、973项目等多项课题。主编教育部高等教育“ 十一五” 国家级规划教材《放射肿瘤学》, 联合主编国家卫生计生委住院医师规范化培训教材《肿瘤放射治疗学》。发表论文60余篇, 其中SCI论文20余篇, 2010年和2011年分别在美国放疗年会发言, 2012年2月应日本国际放疗先进技术大会专题发言。 |
Solomon BJ, Cappuzzo F, Felip E, et al. Intracranial efficacy of Crizotinib versus chemotherapy in patients with advanced ALK-positive non-small-cell lung cancer: Results from PROFILE 1014[J]. J Clin Oncol, 2016, Mar 28. pii: JCO635888. [Epub ahead of print]
1c。
• 克唑替尼是抑制ALK/ROS1/MET的ATP竞争性多靶点蛋白激酶抑制剂, 对ALK阳性的非小细胞肺癌(non-small cell lung cancer, NSCLC)有显著的抗肿瘤作用。PROFOLE 1014Ⅲ 期研究已证实, 克唑替尼可以作为晚期ALK阳性NSCLC的一线标准治疗方案。
• 脑是肺癌常见的转移部位, 具有较高的发病率和死亡率, 在ALK阳性NSCLC患者中, 约有23%~31%发生脑转移。
• 既往研究表明克唑替尼治疗无症状、ALK阳性的脑转移NSCLC患者具有高达60%的颅内疾病控制率(intracranial disease control rate, IC-DCR)。
比较克唑替尼与培美曲塞含铂化疗方案治疗初治、ALK阳性且伴有脑转移的NSCLC患者的IC-DCR。
• 研究条件:PROFILE 1014研究。
• 研究方法:多中心、Ⅲ 期、随机对照临床试验。
• 研究时间:2011年1月到2013年7月。
• 研究对象:年龄≥ 18岁, FISH法测定ALK阳性的进展期非鳞NSCLC患者, 既往未系统治疗; 入组前颅内转移症状稳定2周以上, PS评分0~2, 有可测量的肿瘤病灶。
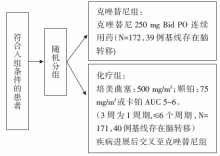
• 干预措施:符合入组条件的患者随机接受克唑替尼或培美曲塞含铂方案化疗, 研究流程见图1。
• 评级指标:主要研究终点指标为无进展生存期(progression-free survival, PFS), 次要终点指标包括:客观缓解率(objective response rate, ORR)、总生存期(overall survival, OS)、颅内疾病进展时间。
343例患者随机入组, 其中79例(23%)患者脑转移, 随机分为两组, 39例入克唑替尼组, 40例入化疗组, 中位随访17.4个月。中位年龄50岁、中位诊断颅内转移时间2.4个月, 以女性、ECOG PS 1、不吸烟者居多。
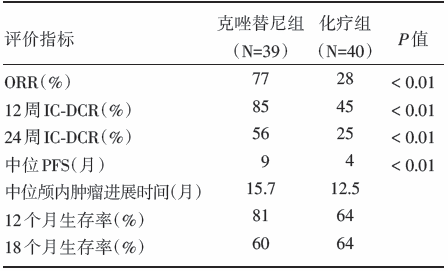
克唑替尼组和化疗组ORR分别为77%和28%, 差异有统计学意义(P< 0.01); 12周和24周IC-DCR分别为85%、45%和56%、25%; 中位PFS分别为9个月和4个月, 差异有统计学意义(P< 0.01); 中位颅内肿瘤进展时间分别为15.7个月和12.5个月; 12个月和18个月生存率分别为81%、64%和60%、64%。具体见表1。克唑替尼组疾病进展发生率少于化疗组(54% vs. 75%), 但在单纯脑进展发生率方面, 克唑替尼组高于化疗组(38% vs. 23%)。
| 表1 两治疗组的疗效比较 |
克唑替尼组治疗相关的不良事件(视力障碍79% vs. 8%, 腹泻54% vs. 8%, 水肿49% vs. 18%, 转氨酶升高44% vs. 11%, 上呼吸道感染26% vs. 8%)均高于化疗组, 而其他不良反应(如乏力、恶心、便秘、食欲减退等)均低于化疗组。
对于初治的伴有脑转移的进展期ALK阳性晚期肺癌, 在颅内控制率方面, 12周和24周时克唑替尼疗效显著好于化疗。
颅内转移是NSCLC常见的临床问题, 它导致较高的死亡率和神经认知障碍率。初诊时ALK阳性的NSCLC脑转移发生率为23%~31%[1, 2], 其生物学行为侵袭, 预后差。目前脑转移的标准治疗是放疗, 但近年来, 随着有效靶向系统治疗与放疗的联合应用, 颅内转移、ALK阳性NSCLC患者的中位生存时间可达49.5月[3]。
在PROFOLE 1014 Ⅲ 期一线克唑替尼与化疗的对比研究中, 对于进展期ALK阳性的NSCLC, 与化疗相比, 克唑替尼可以提高患者的PFS、ORR、肺癌症状改善率和生活质量[4]。而对于颅内转移的ALK阳性的NSCLC, 与化疗相比, 克唑替尼可显著提升患者的中位生存时间(9 个月vs. 4个月, P< 0.01)和ORR(77% vs. 28%, P< 0.01)。
与化疗相比较, 克唑替尼具有延长颅内疾病进展时间的趋势, 虽然未达到统计学意义。但是在颅内疾病控制方面, 克唑替尼12周和24周颅内疾病控制率分别为85%和56%, 显著优于化疗组的45%和25%(P均< 0.01)。克唑替尼组和化疗组的中位颅内肿瘤进展时间分别为15.7个月和12.5个月, 12个月和18个月生存率分别为81%、64%和60%、64%。克唑替尼组疾病进展发生率少于化疗组(54% vs. 75%, P = 0.69), 但颅内进展发生率高于化疗组(38% vs. 23%), 鉴于以上结果, 该研究提出克唑替尼可作为ALK阳性的进展期NSCLC(包括脑转移)患者的标准治疗方案。
因血脑屏障的存在, 一般药物如该研究中使用的培美曲塞和顺铂, 中枢神经系统中的药物浓度远低于周围肿瘤组织, 而研究表明替莫唑胺(TMZ)可以通过血脑屏障, 在脑胶质瘤中的疗效已获证实, 在肺癌等脑转移中亦初显疗效[5]。一项Ⅱ 期研究显示, 替莫唑胺单药治疗30例NSCLC脑转移患者的ORR为10%, 获得缓解患者的无疾病进展时间和OS分别达到11~19个月和14~24个月。另一项Ⅱ 期研究显示, 替莫唑胺联合顺铂序贯全脑放疗治疗50例NSCLC脑转移患者的ORR为16%, 无疾病进展时间和OS分别为2.3个月和5个月。而另两项Ⅱ 期研究显示, 替莫唑胺同步放化疗的ORR可达45%~58%, OS长达12~13个月, 表明同步放化疗可能优于序贯化放疗或单一化疗。故该研究将化疗组作为靶向治疗的对照组, 可能存在一定的误差。
仔细分析该研究的设计方案, 认为该研究可能存在以下不足:(1)在入组标准中, 入组前神经症状稳定至少2周。(2)目前, 脑转移的标准治疗方法是放疗, 而本研究以化疗组作为对照组, 因此得出的结论并不能说明其疗效好于放疗。(3)如患者入组时已有脑转移而研究者未采取目前标准的治疗方式, 研究设计上存在一定不足。
NSCLC已进入靶向治疗的时代, 其中60%的肺腺癌患者都会出现靶向基因突变, 其中包括EGFR和ALK基因突变。对于EGFR突变的患者合并有脑转移, 厄洛替尼合并脑放疗是不错的选择[6], 对于ALK基因突变的患者, 克唑替尼口服联合脑放疗, 也可以达到不错的效果, 而第二代ALK的靶向药物(色瑞替尼或Alectinib)与放疗合用可获得更好的脑转移瘤控制率[7]。
目前, 已有多项研究证实酪氨酸激酶抑制剂治疗肺癌脑转移的有效性, 其中被研究较多的是吉非替尼。日本的一项回顾性研究显示, 在采用吉非替尼治疗的14例颅内和颅外转移的NSCLC患者中, 6例获得颅内病灶缓解。在一项前瞻性Ⅱ 期研究中, 吉非替尼治疗41例NSCLC脑转移患者的ORR为10%, 中位PFS和OS分别为3个月和5个月, 其中腺癌患者的生存期相对较长(P=0.04)。另一项中国的前瞻性研究纳入经筛选的40例肺腺癌脑转移患者, 吉非替尼治疗的有效率为38%, 疾病控制率为92%, 症状改善或消失者达48%, 中位PFS 为9个月, 中位OS为15个月。该研究表明吉非替尼治疗经筛选的脑转移患者的疗效优于未筛选者[8]。因此, EGFR突变或具有特定临床特征的脑转移患者接受TKI治疗的临床获益可能更明显, 但单纯靶向治疗疗效显著低于放疗和靶向合用者[7]。
曾行颅内放疗的患者克唑替尼治疗的总体有效率及控制的持续时间有所改善, 颅内总体有效率为 33%, 12 周时的疾病控制率为62%, 中位进展时间为13.2个月[9]。重要的是, 持续应用克唑替尼的患者尽管出现进展, 但OS相比进展期未持续应用该药的患者来说要长。克唑替尼作为一线治疗的Ⅲ 期试验纳入了79例此前曾对脑部转移灶进行放疗的患者, 发现颅内进展的中位时间与化疗组相似。有研究报道[10], ALK重排脑转移患者放疗后生存时间显著长于ALK野生型患者, 这可能是由于血脑屏障渗透性增强、放疗后数周内P-糖蛋白表达降低所致。尽管联合治疗会带来副作用增加的风险, 但ALK抑制剂副作用少还是可以联合放疗协同治疗ALK重排脑转移患者, 并且放疗后渗透性的增强可以进一步增强靶向治疗的效果。
因此, 需强调的是靶向治疗和放疗的顺序, 各项相关研究均表明ALK抑制剂持续应用有获益[11], 但尚未进行不同ALK抑制剂的疗效比较。有研究表明全脑放疗后应用克唑替尼可以改善颅内病变的控制[7]。总之, 数据表明可以推荐放疗后再次应用ALK抑制剂治疗, 且可能会提高药物疗效。
对于脑转移的ALK阳性进展期肺腺癌病例, 需进行肿瘤内科、放疗科、神经外科等参与的多学科讨论。如果出现无症状脑转移者可单独应用靶向药物治疗。对于颅内病变广泛、有症状患者, 目前标准的治疗模式仍是放疗, 可考虑进行立体定向放疗或全脑放疗。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|