| 陈龙华, 主任医师、教授、博士研究生导师。 1997-2016年担任南方医科大学南方医院放疗科主任。曾任广东省医学会放射肿瘤学分会主任委员2届(2005-2012年), 中华医学会放射肿瘤学会常委, 广东省抗癌协会肺癌专业委员会副主任委员, 广东省肝脏病协会副会长。现任广东省医师协会放射肿瘤专科医师分会主任委员、广东省医学会放射肿瘤学分会名誉主任委员、国际肺癌研究协会常委。1998年在国内率先开展CT模拟与三维适形放射治疗, 在肿瘤影像诊断与肿瘤现代放射治疗方面有深入的研究。获广东省科技进步一等奖1项, 二等奖1项, 军队科技进步二等奖3项, 三等奖5项, 军队医疗成果二等奖1项, 总后勤部及中华医学会优秀卫生电视教材一等奖各1项。获中华医学会广东分会优秀论文一等奖1次, 主编学术专著4部, 参与编著8部, 出版发行多媒体教学课件2部。主持或完成了4项国家自然科学基金项目, 数十项广东省自然科学基金、广东省科技计划项目及广东省卫生计生委基金项目等。主持广东省肿瘤放射治疗学精品课程1项。发表论文160余篇, 其中SCI论文30余篇, 总影响因子100余分。培养博士研究生28名, 硕士研究生25名。 |
Magnuson WJ, Yeung JT, Guillod PD, et al. Impact of deferring radiation therapy in patients with epidermal growth factor receptor-mutant non-small cell lung cancer who develop brain metastases [J]. Int J Radiat Oncol Biol Phys, 2016, 95(2): 673-679.
2b。
• 约25%~40%的非小细胞肺癌(non-small cell lung cancer, NSCLC)患者最终出现脑转移, 在EGFR突变患者中风险更高。
• 前瞻性研究显示, 对未经表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)治疗的脑转移患者预先单独使用厄洛替尼, 其客观有效率(objective response rate, ORR)达到70%~89%, 中位无进展生存期(progression-free survival, PFS)6.6~14.5个月, 中位总生存期(overall survival, OS) 15.9~21.9个月。
• 目前尚无随机研究评价EGFR-TKI先于放疗(radiation treatment, RT)对比RT先于EGFR-TKI的疗效差别。
回顾性分析EGFR突变肺腺癌脑转移患者先用EGFR-TKI、延迟RT, 对患者颅内PFS及OS的影响。
• 研究条件:经耶鲁大学伦理委员会批准在XXXX医院接受治疗的病例。
• 研究方法:回顾性病例分析。
• 研究时间:2008年7月1日至2014年12月31日。
• 研究对象:新诊断未经TKI治疗的脑转移患者。
· 排除标准:接受过EGFR-TKI治疗, 有EGFR-TKI耐药突变, 立体定向放射外科手术(stereotactic radiosurgery, SRS)治疗或者全脑放疗(whole-brain radiation therapy, WBRT)后未接受EGFR-TKI治疗, 在诊断脑转移时接受手术切除, 以及病例记录信息不全、少于6个月随访时间。
• 干预措施:所有病例经多学科讨论评估。若脑转移在重要的位置或肿瘤进一步增大影响神经系统的严重后果, 则先行SRS或WBRT, RT结束后1~2周内接受厄洛替尼治疗, WBRT剂量30 Gy/10 F, SRS剂量依据RTOG 90-05 和95-08调整; 其余将先接受厄洛替尼150 mg/天直到颅内进展, 然后接受RT评估和标准局部治疗。
• 评价指标:生存期、颅内PFS和治疗失败模式。
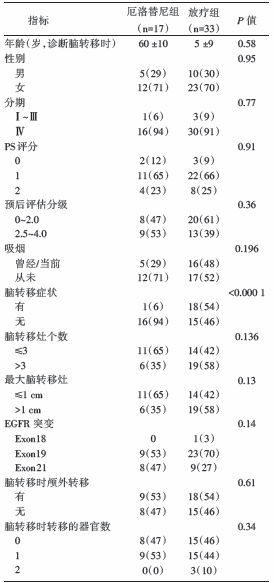
筛选202例患者, 71例进展为脑转移, 其中21例被排除(8例接受了EGFR-TKI, 7例随访少于6个月, 3例有EGFR-TKI耐药突变, 3例在RT后未接受EGFR-TKI治疗), 纳入50例患者。纳入分析病例的特征见表1。其中先接受厄洛替尼17例, 先接受WBRT 17例, 先接受SRS 16例, 采用RECIST评价标准。
| 表1 纳入分析病例的特征 |
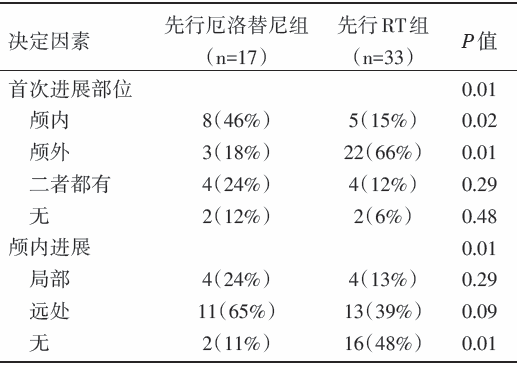
治疗失败模式:二组患者间疾病进展情况有差异, 厄洛替尼组首先出现颅内转移较多, RT组首先出现颅外转移较多, 见表2。
| 表2 治疗失败模式 |
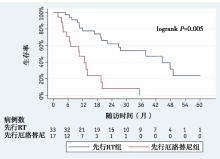
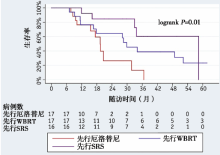
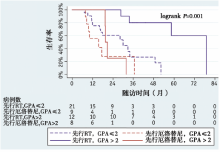
生存期:中位随访20.6个月(7.1~78.9个月), 中位OS 31.7个月; 先行RT组的OS明显长于先行厄洛替尼组(31.4个月 vs. 19.4个月, P=0.01), 见图1。先行SRS、先行WBRT和先行厄洛替尼治疗患者的中位OS 分别为58.4个月、29.9个月和19.4个月。先行SRS组较先行厄洛替尼组OS延长(58.4个月 vs. 19.4个月, P< 0.01), 见图2。分层分析显示, 先行RT组(ds-GPA 2.5-4.0)较先行厄洛替尼组具有更好的生存预后 (78.9个月 vs. 19.5个月, P< 0.01), 见图3。
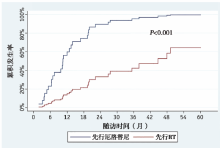
颅内进展:先行RT组, 只有52%颅内进展, 而在厄洛替尼组, 89%出现颅内进展, 二组间总颅内进展发生率有显著差异(P< 0.01), 见图4。
挽救放疗:17例先行厄洛替尼组中, 12例颅内进展接受放疗(7例SRS, 5例WBRT)。
死亡原因:30例死亡, 死因明确24例。15例死于颅外转移进展, 5例死于颅内进展, 4例死于其它原因(2例肺栓塞, 1例肺纤维化, 1例弥漫性血管内凝血)。先行厄洛替尼组死因明确的患者44%(4/9)死于颅内进展, 而先行RT组7%(1/15)死于颅内再次进展。
EGFR突变脑转移NSCLC, 先行EGFR-TKI, 延迟SRS或WBRT, 可能影响OS及颅内PFS。数据需要进一步前瞻性、多中心、随机对照研究证实。
近期, 一篇高影响因子的临床研究论文《Impact of deferring radiation therapy in patients with epidermal growth factor receptor-mutant non-small cell lung cancer who develop brain metastases》发表在了放疗专业的红皮杂志上, 该项研究通过对三组伴有脑转移的EGFR突变型NSCLC患者(组1:先接受EGFR-TKI靶向治疗再接受WBRT或SRS; 组2:先接受WBRT再接受EGFR-TKI靶向治疗; 组3:先接受SRS再接受EGFR-TKI靶向治疗)的OS与颅内进展情况进行分析, 得出了先接受EGFR-TKI靶向治疗后实施RT可能导致伴有脑转移的EGFR突变型NSCLC患者获得较短OS的结论, 突出了在进行EGFR-TKI靶向治疗前尽早实施RT的重要性。
纵览近年的相关研究报道, 该项研究所得结论的主要理论依据可陈述如下:
迄今为止, 已有多项研究表明电离辐射可使血脑屏障遭到破坏。WBRT能够增强抗癌药物(例如伊立替康、甲氨蝶呤以及顺铂)对脑脊液的渗透。Qin的研究指出, 对脑肿瘤患者予以总剂量为20 Gy的WBRT联合甲氨蝶呤静脉注射后, 脑脊液中的甲氨蝶呤浓度可较未行WBRT患者升高3倍。而关于WBRT过程中EGFR-TKI(吉非替尼)对血脑屏障渗透性的改变, 研究人员也于近年发表了引人注目的成果。上述研究入组了19例伴有脑转移的NSCLC患者, 其中4例患者由于接受吉非替尼靶向治疗30天后出现疾病进展而被剔除, 余下15例患者则在接受吉非替尼靶向治疗30天后继续接受了吉非替尼靶向治疗联合同步WBRT。药代动力学结果显示, 吉非替尼的脑脊液浓度及其脑脊液/血浆比率均随WBRT总剂量的升高而升高(图5[1])。吉非替尼在WBRT总剂量为30 Gy和40 Gy时的平均脑脊液浓度显著高于未行WBRT时的平均脑脊液浓度。吉非替尼的脑脊液/血浆比率在WBRT总剂量为30 Gy时可达到峰值, 且显著高于未行WBRT时的脑脊液/血浆比率。该药代动力学结果表明, 联合WBRT能够显著增强吉非替尼在脑脊液中的渗透能力[1]。
近年来, 肿瘤免疫治疗领域取得的成功也向我们展示了免疫系统对于肿瘤细胞的清除能力, 使得人们重新燃起了寻找可诱导患者抗肿瘤免疫应答方法的热情。天然的抗肿瘤免疫应答能够在一部分恶性肿瘤患者中被检测到, 且可通过限速免疫抑制机制将其重新激活。然而, 在大部分患者当中, 采取干预措施从而重新诱导抗肿瘤免疫应答是十分必要的。越来越多的证据表明, 针对肿瘤的放射治疗能在伴随着促炎信号的恶性肿瘤细胞死亡的过程中, 通过诱导抗原释放将其转换为原位肿瘤疫苗, 从而触发固有免疫系统激活肿瘤特异性T细胞。此外, 放射治疗对于肿瘤微环境的影响能够促进活化T细胞的浸润, 且能克服一部分肿瘤排斥的障碍。因此, 放射治疗对于抗肿瘤免疫启动阶段和效应阶段的这种作用, 使其成为有效的影响因素, 通过免疫记忆产生对抗患者自身肿瘤的免疫力, 从而导致持久的系统性应答[2]。
在针对伴有脑转移的NSCLC患者的治疗过程中, WBRT和SRS对脑转移灶放射治疗发挥了至关重要的作用。传统认为, 存在多发脑转移瘤的NSCLC患者能够通过接受WBRT从而降低颅内高压症状出现的可能或延迟该症状出现的时间, 同时还能防止神经系统症状的发生。而对于存在有限数量(通常为至多3~4个转移灶)脑转移瘤的NSCLC患者, 局部治疗(SRS或手术治疗)则被强烈推荐[3]。
由Mok等研究人员开展的几项著名的Ⅲ 期临床试验表明[4, 5, 6], 对于进展期的EGFR突变型NSCLC患者, 使用EGFR-TKI为标准的治疗手段。且近期的几项临床前期研究表明[7, 8], RT与EGFR-TKI靶向治疗可能在控制肿瘤方面存在协同作用。然而, 也有研究认为RT联合EGFR-TKI靶向治疗并未显著延长神经系统转移患者的PFS和 OS[9]。
综上所述, 许多研究人员已完成了大量有意义的探索性工作, 证实且突出了实施RT对于伴有脑转移的NSCLC患者的重要性, 然而对于该结论的进一步验证仍需在未来的研究中继续完成。正如该项研究的作者在文中所述, 一项针对该类患者以及上述治疗方案的前瞻性、多中心合作的随机试验研究仍迫在眉睫。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|