| 潘燚, 副主任医师, 放疗科行政副主任, 肿瘤学博士。广东省医学会放射肿瘤分会委员, 中国抗癌协会肺癌专业委员会放疗学组委员, 广东省抗癌协会放疗专业委员会委员, 广东省抗癌协会癌症康复与姑息治疗专业委员会委员。1999年毕业于中山医科大学临床医学系, 2006年获中山大学肿瘤防治中心肿瘤学硕士学位。2013年赴丹麦欧登塞大学攻读双博士。研究方向为肿瘤放射治疗, 专注于肺癌的PET-CT模拟定位放疗、术中放疗以及立体定向放疗(SBRT)。从事肿瘤放射治疗工作多年。主持广东省自然科学基金、广东省医学科研基金等科研项目, 在国外及国内核心期刊发表多篇文章。 |
Schuler M, Wu YL, Hirsh V, et al. First-line Afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor receptor gene mutations and brain metastases [J]. J Thorac Oncol, 2016, 11(3): 380-390.
2a。
EGFR阳性的非小细胞肺癌(non-small cell lung cancer, NSCLC)出现脑转移的概率高达44%~63%, 但目前极少有针对此类患者的前瞻性临床研究。部分研究表明阿法替尼可通过血脑屏障控制EGFR阳性NSCLC的脑转移。LUX-Lung 3和LUX-Lung 6研究表明阿法替尼明显改善EGFR阳性晚期NSCLC患者的无进展生存期(progression-free survival, PFS)和客观缓解率(objective response rate, ORR), 但并未对脑转移患者进行亚组分析。
比较阿法替尼和含铂双药化疗方案作为一线治疗在伴有EGFR突变合并脑转移的NSCLC患者的疗效差异。
• 研究条件:LUX-Lung 3研究, 全球多中心参与; LUX-Lung 6研究, 中国、韩国和泰国参与。
• 研究方法:合并LUX-Lung 3和LUX-Lung 6两项Ⅲ 期随机对照研究的脑转移亚组数据进行分析。
• 研究对象:未接受过治疗的EGFR阳性、肺腺癌患者同时合并无症状或控制良好的脑转移。
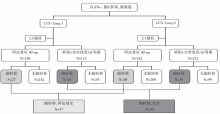
• 干预措施:患者随机接受阿法替尼或含铂双药化疗, 选取脑转移患者进行亚组分析(见图1)。
• 评价指标:PFS、总生存期(overall survival, OS)、ORR、疾病控制率(disease control rate, DCR)、安全性。
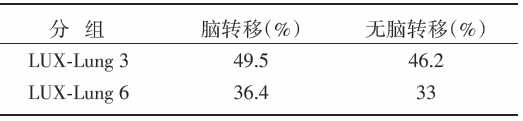
(1)LUX-Lung 3和LUX-Lung 6两项研究不同治疗组、有或无脑转移人群间基线的临床特征均衡。
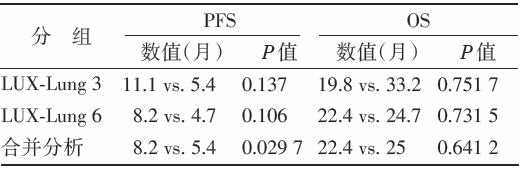
(2)对于脑转移的患者, 阿法替尼与化疗相比显著延长PFS, 而OS无明显差异, 见表1。
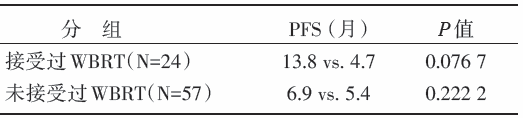
(3)脑转移患者中, 阿法替尼对于接受过全脑放疗(whole brain radiotherapy, WBRT)的患者PFS获益更大(与化疗比较), 见表2。
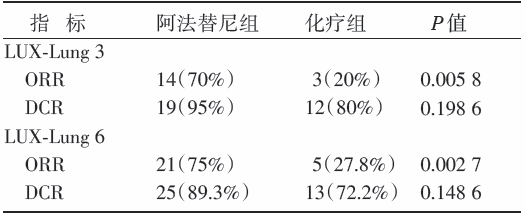
(4)对于脑转移的患者, 阿法替尼较化疗显著提高ORR, 见表3。
(5)在脑转移患者中, 阿法替尼未增加毒性反应, 见表4。
| 表1 阿法替尼对脑转移患者PFS、OS 的影响 |
| 表2 阿法替尼对是否接受过全脑放疗人群PFS 的影响 |
| 表3 阿法替尼对脑转移人群ORR 及DCR 的影响 |
| 表4 阿法替尼对两组人群3/4 级急性毒副反应的影响 |
阿法替尼可用于EGFR阳性合并无症状脑转移的NSCLC患者。
晚期NSCLC患者脑转移的发生率为25%~30%[1], 在EGFR阳性患者更是高达44%~63%[2, 3]。脑转移患者的标准治疗方案为WBRT, 然而, 接受WBRT后, 患者的生存时间超过6个月时会出现认知功能障碍导致生活质量降低。随着 酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)的应用, 伴有脑转移NSCLC患者的生存期显著延长, 中位OS最长可达14.8个月[4], 如何给予这部分人群最佳的治疗策略、提高患者生活质量越来越受到临床医生的关注。有报道TKI可穿过血脑屏障, 对于脑转移病灶的有效率最高可达80%[5], 但这一结果缺乏大样本研究证实。
Schuler等基于LUX-Lung 3和LUX-Lung 6两项Ⅲ 期随机对照临床试验对脑转移患者进行亚组分析, 评价阿法替尼对EGFR阳性合并脑转移患者的疗效及安全性, 结果显示:与化疗相比, 阿法替尼显著延长了EGFR突变合并脑转移NSCLC患者的PFS, 并且PFS的获益在接受过WBRT的患者中更为显著。有学者提出WBRT可打开血脑屏障, 有助于EGFR-TKI进入脑从而控制脑转移灶的假说, 然而也有研究结果并不支持这一假设[6, 7]。关于TKI与放疗结合的时机目前尚无定论, 回顾性研究显示出不同的结果, Gerber等[8]的研究显示, TKI治疗前进行WBRT能显著提高颅内转移灶控制率及进展时间, 但颅内控制率并不能转化为PFS或OS优势。Magnuson等[9]的研究表明, 提前脑部放疗(包括WBRT和立体定向放射外科手术)显著延长了OS, 特别是接受了立体定向放射外科手术治疗的患者; 但Liu等[10]的研究显示, 对于EGFR突变的脑转移患者一线WBRT并未有生存获益。因此, 现有的循证医学证据对于TKI与WBRT结合的时机仍存在较大争议, 急需前瞻性研究结果揭示不同治疗组合的最佳方式。
得益于LUX-lung 3和LUX-lung 6的入组标准及方案基本一致, Schuler等的研究及亚组患者之间的基线特征及入组前接受WBRT治疗的比例都非常均衡, 排除了混杂因素的干扰, 为合并分析提供基础; 将两项研究的亚组合并分析增加了样本量、提高了检验效能, 使统计结果更加可信。但该研究并未分析TKI治疗后颅内转移灶的ORR或颅内PFS, 因此不能评价阿法替尼对颅内病灶局部控制的情况; 另外, 虽然将两项研究进行了亚组合并分析, 但病例数仍偏少, 由于样本量的限制, 一线WBRT再接受阿法替尼治疗的患者虽显示有生存获益, 但差异没有统计学意义。
EGFR-TKI对于脑转移患者的一线治疗及TKI与放疗结合的时机仍需进一步前瞻性随机对照临床研究证实; 此外, 不同放疗方式的疗效, 如立体定向放射外科手术或分次立体定向放疗, 对神经功能的影响也是临床关注的热点。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|