李某, 男, 56岁, 于2015年6月11日因“ 腹痛腹胀半年” 收入院。
现病史:患者于半年前无明显诱因出现左上腹闷痛, 疼痛局限, 空腹时加剧, 饱餐后伴腹胀感, 无恶心、呕吐, 无呕血, 无黑便, 无头晕、头痛, 无反酸、嗳气, 无胸闷、胸痛, 无烧灼感, 自行服用“ 胃药” , 未见明显好转, 外院胃镜检查提示:胃窦小弯侧至胃角见黏膜水肿溃烂, 覆以污苔, 边缘虫蚀样, 黏膜呈堤样隆起, 大小约4 cm × 5 cm, 病理诊断为胃窦印戒细胞癌。自发病以来, 精神、睡眠一般, 胃纳差, 大小便正常, 近半年体重下降约10 kg。
既往史、个人史、婚育史、家族史等无特殊。
查体:T 36.2℃, P 80次/分, R 20次/分, BP 115/75 mmHg, 体重 56 kg, 身高168 cm, 神志清醒, 全身浅表淋巴结未扪及肿大。咽部无充血, 扁桃体无肿大。双肺叩诊音清, 呼吸音清, 未闻及湿罗音。心率80次/分, 心律齐。专科查体:腹部外形正常, 未见静脉曲张; 肠鸣音约4次/分, 无气过水声; 移动性浊音(-); 腹部包块(-), 左侧上腹部压痛(+), 反跳痛(-), 肝、脾、胆囊肋下未触及。
辅助检查:2015年6月4日外院胃镜提示胃窦印戒细胞癌。
血常规:白细胞计数 8.36× 109/L , 中性粒细胞73.4%, 血红蛋白91 g/L, 血小板 90.9× 109/L。
肿瘤指标: AFP 1.81 ng/mL(参考范围0~9 ng/mL), CEA 0.7 ng/mL(参考范围0~7 ng/mL), CA19-9 4.92 U/mL。
肝肾功能、心功酶、尿常规、凝血常规未见明显异常。
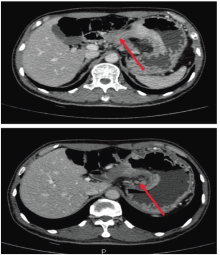
全腹CT平扫+增强影像学:胃小弯-胃窦部胃壁增厚, 最厚约16 mm, 增强扫描呈明显不均匀强化, 胃小弯侧及胃周淋巴结肿大, 最大12 mm× 11 mm, 余腹腔脏器未见明显转移病灶。影像学诊断:胃小弯至胃窦部胃壁改变, 符合胃癌, 不除外周围淋巴结转移。见图1。
冯兴宇(普外科住院医师):汇报病例特点(略)。提出讨论要点:(1)根据该患者的术前平扫及增强CT图像情况, 该如何进行术前分期?(2)治疗方法。
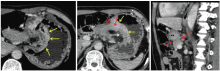
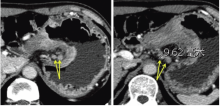
王秋实(影像科主任医师):目前对于胃癌的术前分期, 最为常用的为多排螺旋CT, 以美国癌症联合会(AJCC)第7版TNM分期系统为依据[1]。其中T分期的CT诊断标准为:T1a期肿瘤局限于黏膜层内; 多排螺旋CT上肿瘤表现为内层黏膜强化和(或)黏膜增厚。T1b期肿瘤局限于黏膜下层; 多排螺旋CT上条状低密度层破坏< 50%厚度。T2期肿瘤局限于固有肌层, 多排螺旋CT上条状低密度层破坏≥ 50%厚度, 与略高密度的外层不相邻。T3期肿瘤局限于浆膜下; 多排螺旋CT上强化的肿瘤与外层已不可分, 外层外侧缘光滑或胃周脂肪界面少量线条状影。T4a期肿瘤侵犯浆膜层; 多排螺旋CT上外层外侧缘结节状或不规则和(或)胃周脂肪界面致密带状浸润。T4b期肿瘤侵犯邻近结构; 多排螺旋CT上胃肿瘤与邻近器官的脂肪界面消失或直接侵犯邻近器官。根据此项标准多排螺旋CT胃癌总的T分期准确率为77.2%~82.7%[2]。该患者的T分期表现(见图2):胃小弯和胃窦部胃壁明显增厚并异常强化(黄色箭头), 局部浆膜面外凸毛糙(白色箭头), 病变处胃周脂肪层密度增高, 见索条状致密影; 病变处胃壁与胰腺之间脂肪界面消失, 并经矢状位重建进一步证实(红色箭头)— — T4b。N分期:AJCC胃癌N分期体系建立在淋巴结转移数目的基础上, 如何在多排螺旋CT图像上判定区域性淋巴结转移成为关键。目前尚无一个被广为认可的淋巴结转移多排螺旋CT评价标准, 阳性淋巴结的判断建议采用多因素综合判断:(1)淋巴结大小(胃周淋巴结短径> 6 mm、胃周以外淋巴结短径> 8 mm); (2)形态改变(淋巴结形态饱满近乎圆形、淋巴门消失); (3)强化方式(显著强化超过80或100 HU、不均匀强化、中心坏死); (4)局部淋巴结成簇分布(数目> 3个); (5)胃癌的分型(Borrmann Ⅲ 或Ⅳ 型)。结合淋巴结大小、形态、密度及强化综合考虑, 该患者胃周共6枚淋巴结考虑转移可能性较大(见图3)— — N2。M分期:该患者未发现其余远处脏器、远处淋巴结和腹膜转移, 因此为M0。综上, 该患者的术前分期为:cT4bN2M0。
冯兴宇:下面我们来讨论该患者的治疗方案。按照全程管理的理念, 我们制定了三个决策方案:(1)直接手术; (2)新辅助化疗+手术治疗; (3)新辅助放化疗+手术治疗。请大家讨论应该选择哪种方案, 或者给出其他治疗方案的建议。
杨冬阳(肿瘤内科主治医师):根据患者的术前分期情况, 可以考虑进行术前新辅助化疗。采用新辅助化疗的意义在于:有望使肿瘤降期, 增加手术切除率; 有望缩小肿瘤, 增加R0切除率; 有望在早期阶段, 治疗微转移灶; 有望在早期筛选出不适合做手术的病例, 避免手术带来的创伤, 选择更有效的治疗手段。
马冬(肿瘤内科主任医师):胃癌的新辅助化疗目前的循证医学证据比较充分, 其中比较经典的临床试验有MAGIC研究和FNCLCC/FFCD, 这两项研究均证实新辅助化疗可以改善患者的生存[3, 4]。因此建议予以新辅助化疗, 力争肿瘤缩小后再行手术治疗。
孙恒文(放疗科主治医师):胃癌的新辅助治疗方法还包括新辅助放化疗, NCCN指南对于T2以上的肿瘤推荐的术前治疗方法除了术前化疗, 还建议可行术前放化疗。但关于术前放化疗的证据级别较低, 为2B级。而我国卫生计生委胃癌诊疗规范2011版规定:局部晚期不可手术切除者(T4NxM0), 可考虑术前同步放化疗, 治疗后重新评估, 争取行根治性手术。卫生计生委胃癌放射治疗临床路径(2012年版)指出:T2以上或者N+的局部进展期病灶, 术前放化疗可能降低分期提高手术切除率。因此, 该患者除化疗外可考虑术前放化疗。
杨衿记(肿瘤内科主任医师):目前术前放化疗的临床研究情况如何?是否有对比术前放化疗和术前化疗的研究?
曾子君(放疗科副主任医师):目前胃癌的术前放化疗研究多为Ⅱ 期研究, 放疗剂量爬坡至45 Gy/25 F, 化疗方案尚无定论, 总体评价安全、有效, 放化疗后的病理完全缓解率目前报道为15%~20%[5, 6]。
李勇(普外科副主任医师):比较胃癌术前放化疗和术前化疗疗效的研究有一项Ⅲ 期临床研究, 但因入组缓慢提前关闭, 该研究的结果显示术前放化疗较术前化疗有提高生存的趋势, 但尚未达到有统计学意义的差异。关于病理完全缓解率, 术前放化疗有明显优势(15.6% vs. 2.0%)[7]。目前中山大学肿瘤防治中心开展了一项术前放化疗联合手术及辅助化疗与术前化疗联合手术及辅助化疗治疗进展期胃癌的随机对照研究。我们中心参与了该项研究, 随机分组后, 该患者加入到术前放化疗组。
冯兴宇:经过多学科讨论, 决定采用新辅助放化疗+手术治疗的治疗方案。具体治疗方案为放疗:2015-06-19至2015-07-24, 25次共5周, 5次/周, 共45 Gy; 同期XELOX方案化疗:卡培他滨 1 000 mg/m2 , 奥沙利铂 130 mg/m2, 3疗程。
放化疗结束后再次行CT评估治疗效果。此时我们需要明确该如何对胃癌新辅助治疗后的患者进行再评估。
王秋实:RECIST形态学标准是目前国际通用的实体肿瘤评效准则, 但其在胃肠道癌新辅助化疗的应用却遭遇瓶颈。原因在于胃癌原发灶测量的一致性和可重复性差, 不建议作为可测量靶病灶。而肝、肺或淋巴结转移病灶作为靶病灶具有良好的测量一致性和可重复性, 但大大降低可评价患者的数量。也有采取TNM分期变化作为疗效评估的, 但其本质仍为形态学标准, 良恶性征象交叉较多, 导致分期不准。胃肠癌CT和MRI新辅助治疗前后T分期的准确率从60%~90%下降至40%~70%。此外, 功能影像学评价PET-CT的SUV值变化可早期评价新辅助治疗的疗效。MRI弥散加权成像(diffusion-weighted MRI):ADC值与恶性肿瘤疗效相关, 可作为新的预测和随访恶性肿瘤疗效的生物学行为指标。针对该例患者原发病灶受胃腔形态、充盈度影响, 无法准确测量长径和厚度; 病变与胰腺间脂肪界面仍消失, 但无法从影像学角度区别是炎性反应还是肿瘤侵犯。胃周淋巴结明显缩小、强化仍较明显, 无法判断是否仍有活性转移。因此, 对于胃癌新辅助治疗后的疗效评价, 建议多学科讨论。
吴一龙(肿瘤学教授):该患者参与的临床研究的影像学评价标准是什么?对该患者的疗效评估结果是怎样的?
冯兴宇:采用RECIST 1.1版, 根据该标准, 患者疗效评价为疾病稳定。下一步该如何治疗?
李勇:患者目前影像学评估为疾病稳定, 并未出现远处转移, 因此患者仍然存在根治性切除的手术机会。且根据临床试验研究方案目前应当行手术治疗。
冯兴宇:经科室讨论后, 决定予以手术治疗:腹腔镜探查+全胃切除+食管空肠Roux-en-Y吻合+D2淋巴结清扫。术后病理提示:胃低分化腺癌, Lauren分型:弥漫型, 肿瘤最大径约6.5 cm; 肿瘤浸润胃壁全层至浆膜下脂肪组织; 转移/清扫淋巴结:1/22; 神经束膜侵犯易见, 未见明确脉管癌栓; 两端外科切缘未见癌。最终肿瘤病理分期:ypT3N1M0。我们应该如何从病理学角度评价胃癌新辅助治疗的疗效?
武鸿美(病理科主治医师):新辅助治疗后肿瘤消减的组织学标志包括:泡沫细胞聚集(most specific)、吞噬含铁血黄素的组织细胞反应、胆固醇结晶析出、异物巨细胞反应、营养不良性钙化等。参照的评价标准包括Mandard标准和Becker标准等[8]。该例患者依据Mandard标准评为TRG3级; 依据Becker标准则评为TRG2级。
李勇:该例患者为局部进展期胃癌, 首诊时考虑局部侵犯胰腺, 且多发转移淋巴结, 经多学科讨论后入组临床试验。经过系统化的综合治疗后, 患者取得相对较好的疗效。体现了多学科讨论、协作在目前肿瘤治疗中发挥的巨大作用。
吴一龙:同意李勇主任的意见。因为该患者为入组临床试验的病例。我提醒各位凡是参与临床研究的患者一定要按照临床试验设定好的研究方案进行, 临床研究方案就是金标准, 绝对不允许在治疗过程中擅自修改治疗方案。此外, 对于肿瘤患者, 我建议尽量参与一些高质量的临床研究, 一方面可以使患者从中获益; 另一方面也可推动肿瘤治疗的进步。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|