作者简介: 田金徽(1978-),男,甘肃庆阳人,医学博士,主要从事循证医学与放射肿瘤学的研究。
目的 使用Ioannidis量表和CONSORT声明扩展版全面评价中文发表的乳腺癌随机对照试验不良反应报告情况。方法 计算机检索中国知网数据库、中国生物医学文献数据库、中文科技期刊数据库及万方数据资源,并严格按照纳入排除标准筛选获得中文发表的乳腺癌随机对照试验。采用CONSORT声明扩展版及Ioannidis量表评价和分析所有纳入文献,各条目符合程度由高到低分别评为“1分”、“0.5分”、“0分”。将所获数据录入Excel软件,并使用RevMan5.0软件进行统计分析。结果 共纳入乳腺癌随机对照试验964篇,发表数量总体呈逐年上升之势。 812篇(84.2%)研究提及了不良反应或不良事件,CONSORT总评分为(2.94±1.68)分,中位数为3分;Ioannidis总评分为(0.94±1.00)分,中位数为1分,且所有条目的完整报告率均低于50%。分层分析结果显示:仅Ioannidis评分在中国科学引文数据库期刊来源研究与非中国科学引文数据库期刊来源研究的差异具有统计学意义(P=0.03),其他方面的差异均无统计学意义。结论 中文发表乳腺癌随机对照试验中不良反应的报告不够全面。作者和编辑需互相督促、学习,共同促进不良反应报告质量的提高。
Objective The aim of this report is to make judgment on the safety reporting in randomized controlled trial (RCT) related to breast cancer using Ioannidis checklist and the expanded version of CONSORT statement.Methods Search the China Knowledge Resource Integrated Database(CNKI), Chinese Biomedical Literature Database(CBM), Chinese Scientific Journals Database (VIP) and the Wanfang data resources, and activities in accordance with the inclusion and exclusion criteria to obtain the RCTs of breast cancer. The quality of included reviews was assessed in accordance with the Ioannidis checklist and the expanded version of CONSORT statement. Based on the degree of conformity with each criterion, the reviews were scored as “1”,“0.5” or “0” orderly. The data were put into Excel, and the RevMan5.0 software was used for statistical analysis.Results A total of 964 studies were included, and the number of publications was increasing annually. There were 812 (84.2%) studies mentioned adverse reactions or adverse events, the median of CONSORT score was 3 (2.94 ± 1.68); the median of Ioannidis score was 1 (0.94 ± 1.00), and all the entries were lower than 50%. The results of stratified analysis showed that: the difference of Ioannidis score between CSCD and non CSCD was statistical significance (P=0.03), other differences of other stratified factors didn’t have statistical significance(P>0.05).Conclusion The safety reporting in randomized controlled trial related to breast cancer published of Chinese is not comprehensive enough. That requires authors and editors to supervise and learn with each other, and work together to improve the quality of safety reporting.
随机对照试验(randomized controlled trial, RCT )是一种对医疗卫生服务中的某种疗法或药物效果进行检测的手段, 被认为是临床试验设计的金标准。随着RCT的增多, 其质量引起学者们的重视。20世纪90年代中期, 旨在改进RCT报告质量, 由两个独立工作组促成了一个由临床试验专家、统计学家、流行病学家和生物医学杂志编辑组成的国际小组, 制定了报告临床试验的统一标准(Consolidated Standards of Reporting Trials, CONSORT声明), 用以提高平行随机对照试验的报告质量[1]。然而, 相比成功报告益处带来的赞誉而言, 报告危害也许会带来更多的麻烦和质疑[2], CONSORT声明中仅有一条针对不良反应的项目, 况且从患者的利益出发, 对危害的报告可能会更加有益于临床决策。2002年, Ioannidis和Lau对于如何报告RCT不良反应提出了9条建议[3](以下简称Ioannidis量表), 该建议重点强调RCT研究中需使用系统的方法准则对不良反应数据进行采集和分析。2004年, 为了更好地规范RCT不良反应的报告质量, 由CONSORT小组成员再次制定出一个由10个项目组成的RCT不良反应报告规范(以下简称CONSORT声明扩展版), 并附有详细的解释[4]。自从CONSORT声明扩展版发布后, 关于RCT不良反应报告质量的研究逐渐增多, 一些较为有代表性的研究[5, 6]均提出RCT不良反应的报告质量还有待于提高。
乳腺癌是全球女性中最常见的恶性肿瘤, 也是癌症死亡的首要原因[7]。据2010年《中国卫生统计年鉴》的数据显示, 我国城市和农村女性居民的乳腺癌死亡率分别为9.27/10万和5.65/10万, 位居恶性肿瘤死亡原因的第5位和第6位[8]。本研究团队已经对中文发表乳腺癌RCT的报告质量和伦理学报告质量进行分析[9, 10], 然而其不良反应报告质量如何?本研究旨在使用Ioannidis量表和CONSORT声明扩展版全面评价中文发表乳腺癌RCT不良反应的报告情况。
纳入标准:①2013年6月30日之前公开发表的所有乳腺癌RCT研究; ②文献语种限为中文。
排除标准:①非随机对照试验:有些研究虽然冠名为“ 随机对照试验” , 但实际上并没有严格遵守随机对照试验的研究方法, 如交叉试验、自身前后对照研究、历史性对照研究等; ②病例对照和回顾性研究; ③国外乳腺癌RCT研究的摘要或译文; ④重复发表的文献。
以(随机对照试验 OR 随机对照临床试验 OR RCT)为检索式, 检索中国知网数据库(CNKI)、中国生物医学文献数据库(CBM)、中文科技期刊数据库(VIP)及万方数据资源。检索截止时间均为建库至2013年6月30日, 语种限制为中文。
由两位研究者独立利用计算机检索获得乳腺癌RCT研究文献目录和摘要, 由经统一培训的合格的研究人员阅读文献题目和摘要, 初筛排除明显不符合的文献。而后按照初筛文献目录逐条下载获取全文, 对可能符合纳入标准的文献进一步阅读全文进行二次筛选, 最终获得乳腺癌RCT研究。独立筛选后交叉核对, 如遇分歧讨论解决或与第三方讨论解决。
采用 Excel 资料提取表格。提取CONSORT扩展版和Ioannidis量表所列所有条目及以下信息:第一作者名、发表年代、作者数量、作者单位数量及性质、基金资助等(见表1)。为了保证资料提取的准确性, 由两位研究员独立进行资料提取, 然后交叉核对, 准确无误和意见统一后再进行统计分析。
| 表1 纳入RCT 资料提取条目 |
对纳入RCT的不良反应报告质量分别采用CONSORT扩展版和Ioannidis量表对各个条目的报告符合程度进行打分, “ 完全报告” 记1分, “ 部分报告” 记0.5分, “ 未报告” 记0分。两位评价者独立评价文献质量并交叉核对, 如遇分歧通过与第三方讨论解决。
数据输入Excel表, 采用RevMan5.0软件进行统计分析。计数资料描述采用百分率, 统计分析采用χ 2检验, 设定P ≤ 0.05差异具有统计学意义。
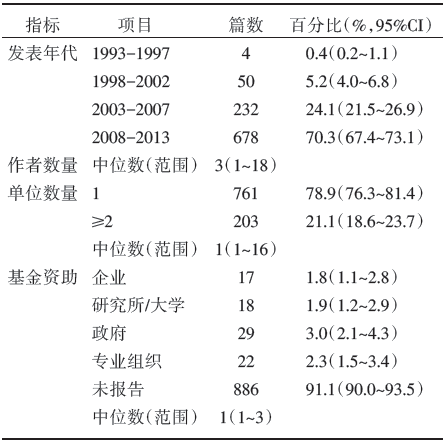
共纳入964篇中文发表的乳腺癌RCT。2008-2013年的研究数量占总数量的70.3%[95%可信区间(confidence interval, CI)67.4%~73.3%]。纳入研究的作者数量1~18名不等, 中位数为3。作者的单位数量范围为1~16个, 中位数为1, 占78.9%(95%CI 76.3%~81.4%)。根据《2013-2014年度中国科学引文数据库来源期刊》将纳入研究的出版杂志分为中国科学引文数据库(Chinese Science Citation Database, CSCD)期刊与非CSCD期刊, 得出非CSCD期刊来源的研究占85.6%(95%CI 83.2%~87.7%)。91.1%(95%CI 90.0%~93.5%)的研究未报告基金资助情况; 资助机构中, 政府所占比例较高, 其余企业、研究所或大学、专业组织所占比例基本相同(见表2)。
| 表2 纳入RCT 基本信息(n=964) |
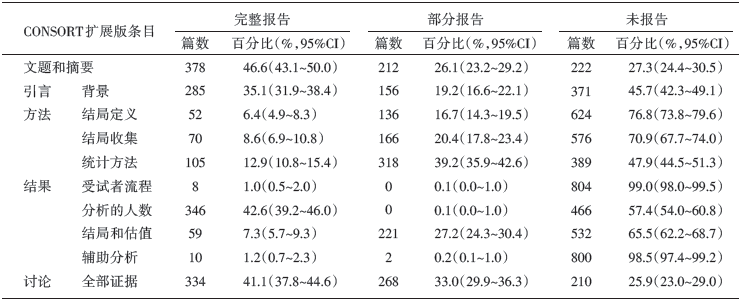
纳入RCT中, 812篇(84.2%)研究提及了不良反应或不良事件。由表3知, CONSORT扩展版所有条目完整报告率均低于50%, 其中, 方法部分的结局定义、结局收集, 结果部分的受试者流程、结局和估值、辅助分析5个条目的完整报告率不及10%, 统计方法条目的完整报告率为12.9%(95%CI 10.8%~15.4%)。CONSORT总评分为(2.94± 1.68)分, 中位数为3分。
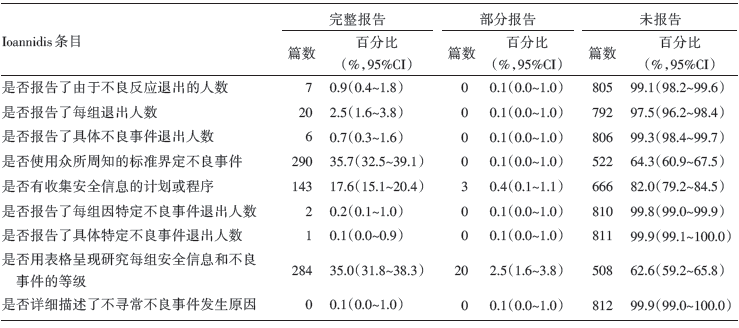
由表4知, Ioannidis量表所有条目的完整报告率均低于40%, 其中, 有35.7%(95%CI 32.5%~39.1%)使用了标准工具界定不良反应; 35.0%(95%CI 31.8%~38.3%)的研究用表格呈现了各个组的安全信息及不良反应的等级; 17.6%(95%CI 15.1%~20.4%)明确报告有收集安全信息的计划和程序; 2.5%(95%CI 1.6%~3.8%)报告了每组的退出人数; 其余5个条目的完整报告率均低于1%。Ioannidis总评分为(0.94± 1.00)分, 中位数为1分。
| 表3 纳入RCT 报告质量评价结果(CONSORT) |
| 表4 纳入RCT 报告质量评价结果(Ioannidis) |
据统计, 报告不良反应的812篇RCT中, CSCD期刊来源的研究Ioannidis评分高于非CSCD期刊来源的研究, 且差异具有统计学意义[均数差(mean difference, MD)=0.23, 95%CI 0.03~0.43, P=0.03]; CONSORT评分亦高于非CSCD期刊来源的研究, 但差异无统计学意义(MD=0.12, 95%CI -0.21~0.45, P> 0.5)。来自一个单位研究的CONSORT平均分高于多单位合作的研究(MD=0.04, 95%CI-0.23~0.31, P> 0.5), 而Ioannidis平均分低于多单位合作研究(MD=-0.15, 95%CI-0.33~0.03, P> 0.5), 但两者的差异均无统计学意义。基金资助研究的CONSORT评分(MD=0.33, 95%CI -0.14~0.80, P> 0.5)和Ioannidis评分(MD=0.10, 95%CI -0.16~0.36, P> 0.5)均高于无基金资助的研究, 但差异无统计学意义。
我国乳腺癌RCT研究最初始于1993年, 仅有1篇, 而2012年有166篇, 可以看出我国学者对乳腺癌的研究越来越重视。绝大部分研究作者≤ 5人, 且大多数均来自于同一个单位, 由此看来, 多个研究人员的参与及在多机构跨国界合作能力方面仍有待于加强。85.6%的研究发表于非CSCD期刊, 说明该领域的研究整体质量较低。91.1%的研究未报告基金资助情况; 资助机构中, 政府所占比例较高, 其余企业、研究所或大学、专业组织所占比例基本相同。
现阶段的RCT中, 不良反应或不良事件的报告质量普遍较低。Ioannidis等统计了60篇有关艾滋病病毒的研究, 发现仅有少部分研究提供了较为充分的信息。为了证明这一说法, 他们统计到纳入研究中不良反应或事件所占的字符数少于作者姓名的字符数[11]。在之后的研究中, 他们又得出192篇研究中仅有29%的研究充分报告了不良反应[3]。目前, 尽管不良反应的报告质量有所改善, 但仍有待提高。
由本研究亦可以看出, 中文发表乳腺癌随机对照试验中不良反应的报告质量与其他同类研究得出的结论一样:15.8%的研究完全未涉及到不良事件或者不良反应; 在纳入文献中, CONSORT平均分为(2.94± 1.68)分, 中位数为3分, Ioannidis平均分为(0.94± 1.00)分, 中位数为1分, 整体报告水平较低。且无论是CONSORT扩展版还是Ioannidis量表, 所有条目的完整报告率都处于低下水平。相比之下, 研究者更愿意在文题或摘要以及讨论部分提及不良反应或不良事件, 有74.1%的研究在讨论部分提及不良反应或不良事件。99.0%的研究未描述每组因危害和对分配治疗方案的感受而退出的受试者, 另有98.5%的研究未描述与危害相关的任何亚组分析和探索性分析, 大大降低了研究的可信程度, 并导致偏倚的产生。纳入的所有研究均未描述不寻常不良事件发生的原因, 这在一定程度上给临床决策者的诊治带来了诸多困扰和迷惑。在特定不良事件引起的人员脱落方面, 不论是脱落人数还是具体描述特定不良事件, 几乎所有的研究均未提及。
笔者欲从研究来源期刊、作者单位数量及基金资助情况三个方面分别比较其对不良反应报告质量的影响, 所得结果不甚乐观。Ioannidis评分仅在CSCD期刊来源研究与非CSCD期刊来源研究间的差异具有统计学意义(P=0.03), 其他方面的差异均无统计学意义。而CONSORT评分在上述三方面的差异均无统计学意义。
本研究结果显示, 以下几方面需要临床工作者及研究人员多加注意:①在其他更全面、科学的RCT不良反应报告规范出台以前, 请尽可能地遵循CONSORT扩展版及Ioannidis量表条目对RCT的不良反应进行结构化报告, 使得不良反应的报告更为规范, 为目标使用者提供更清晰明了的诊治建议; ②对于研究员, 需从思想上进一步提升对RCT不良反应重要性的认识, 同时规范、详细地进行报告, 提升国内RCT的质量和国际影响力; ③RCT不良反应报告质量的提高, 不能仅依靠作者单独的力量, 杂志编辑也发挥着重要的作用。他们可以要求并督促作者去进一步完善相关内容。笔者主张每篇RCT研究都应对不良反应或事件进行充分的说明并作出必要的解释。
①本研究只收集了中文发表乳腺癌的RCT, 故本研究的结果仅能说明中国乳腺癌RCT的不良反应报告质量现状, 不能代表其总体趋势; ②RCT并不是唯一能得到不良反应报告数据的资源, 国家或国际药物警戒机构、药物售后检测等也是得到药物不良反应数据的重要工具。故欲得到最真实的信息, 须全面结合所有相关类型的研究[12]。
中文发表乳腺癌RCT中不良反应的报告不够全面。任何治疗都有不良反应的存在, 各研究员必须注明收集不良反应数据的计划和流程, 并在研究中公开不良反应的相关数据, 必要时需附上解释说明。作者和编辑者需互相督促、学习, 共同促进不良反应报告质量的提高。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|