作者简介: 田跃军(1987-),男,河南漯河人,医师,硕士研究生,从事泌尿系肿瘤和循证医学研究。
目的 系统评价缺氧诱导因子-1α(HIF-1α)蛋白表达与前列腺癌临床、病理特征及预后的关系。方法 计算机检索PubMed、Cochrane图书馆、EMBASE、中国知网、维普等数据库,检索时限均截至2016年5月1日,搜集有关HIF-1α 蛋白表达水平与前列腺癌临床、病理特征和预后关系的研究,采用RevMan 5.3软件进行Meta分析,用NOS质量评价量表对纳入文献进行评估。结果 最终纳入19篇文献,共计1 503例受试者,其中前列腺癌组1 125例,良性前列腺增生组378例。Meta分析结果显示:HIF-1α蛋白表达水平前列腺癌组显著高于前列腺增生组,合并比值比=14.30(95%可信区间7.41~27.60),在Whitmore-Jewett临床分期中C+D期组明显高于A+B期组,合并比值比=8.51(95%可信区间4.90~14.80),TNM临床分期中Ⅲ+Ⅳ期组明显高于Ⅰ+Ⅱ期组,合并比值比=4.93(95%可信区间2.84~8.57),病理分级中低分化组明显高于高中分化组,合并比值比=5.53(95%可信区间3.74~8.18),伴淋巴结转移组明显高于无淋巴结转移组,合并比值比=7.09(95%可信区间3.87~12.98),其差异均有统计学意义。年龄大于65岁组与小于等于65岁组的对比研究发现,合并比值比=1.66(95%可信区间0.86~3.20),差异无统计学意义。HIF-1α蛋白表达水平对前列腺癌的无进展生存时间和无转移生存时间均有影响,合并后风险比分别为0.37(95%可信区间0.17~0.81)和9.80(95%可信区间1.50~63.86)。结论 现有证据证明,HIF-1α参与了前列腺癌的发生、发展过程,可能是前列腺癌的一个潜在的肿瘤生物标志物。
Objective To provide a comprehensive meta-analysis of the extent of the possible association between hypoxia-inducible factor 1α (HIF-1α) and the risk of prostate cancer (PCa).Methods Such databases including PubMed, The Cochrane Library, EMBASE, CNKI, and VIP Database were searched from inception to May 1st 2016, for studies about the association of the clinical significance and prognostic value of HIF-1α expression in PCa. Then, meta-analysis was performed using RevMan 5.3 software. The NOS scale was used to evaluate the quality of the literature.Results Nineteen relevant studies, which had a total of 1 503 patients enrolled, involving 1 125 PCa, 378 benign prostatic hyperplasia (BPH). The results of meta-analysis showed that: HIF-1α protein expression was higher in PCa group than that in BPH group (OR=14.30, 95%CI 7.41~27.60). The results of the meta-analysis showed significant associations between HIF-1α protein expression and higher tumor stage (C+D and Ⅲ+Ⅳ), high tumor grade or positive lymph node metastatic status, respectively, the combined ORs and 95%CI were as follows: OR=8.51, 95%CI 4.90~14.80; OR=4.93, 95%CI 2.84~8.57; OR=5.53, 95%CI 3.74~8.18; OR=7.09, 95%CI 3.87~12.98. There was no significant association between HIF-1α protein expression and age (>65 vs. ≤65), the combined OR and 95%CI were OR 1.66, 95%CI 0.86~3.20. Additionally, significant correlations between HIF-1α protein expression and survival outcome (progression-free survival and metastasis-free survival) were also observed in PCa patients, the combined OR and 95%CI were OR 0.37, 95%CI 0.17~0.81; OR 9.80, 95%CI 1.50~63.86.Conclusion The present results indicate that over-expression of HIF-1α is distinctly correlated with an increased risk and poorer survival in PCa patients. HIF-1α may serve as a valuable biomarker for prognosis in PCa patients.
前列腺癌(prostate cancer, PCa)在全球男性恶性肿瘤中发病率居于第二位, 每年全球新发病例数近110万, 死亡人数超过30万。在我国, 近几年PCa的发病率和死亡率均呈明显增长趋势, 严重威胁着老年男性的健康和生命[1, 2]。目前公认的前列腺癌标志物是前列腺特异性抗原(prostate-specific antigen, PSA), 但PSA对前列腺组织存在特异性, 而对前列腺癌无明显特异性。而且当总PSA介于4~10 ng/mL时存在灰区, 为明确诊断需进一步行前列腺穿刺活检, 作为一种有创检查存在感染、血精、血尿等并发症, 增加了早期诊断的风险[3]。因而寻找一些新的肿瘤标志物对于前列腺癌的诊断和治疗意义重大。有研究发现, 缺氧诱导因子-1α (hypoxia-inducible factor 1α , HIF-1α )作为一种在低氧环境下发挥重要调控作用的因子, 在细胞增殖、分化、肿瘤血管生成、DNA修复等生命活动中发挥着重要作用, 在多种肿瘤中存在异常表达, 其在前列腺癌中的高表达影响着前列腺癌的发生、发展和预后, 其有可能成为前列腺癌的新的生物标志物[4, 5, 6]。
近几年国内外众多学者对HIF-1α 蛋白表达与前列腺癌及其临床病理和预后特征关系进行了研究, 但同类研究参差不齐, 研究结果不一。本研究采用Meta分析方法对国内外相关研究进行综合分析, 以期为进一步明确HIF-1α 与前列腺癌的关系提供循证医学依据。
计算机检索PubMed、Cochrane图书馆、EMBASE、中国知网、维普等数据库, 查找有关HIF-1α 蛋白表达与前列腺癌及其临床病理和预后特征相关的文章, 检索时限均为从建库至2016年5月1日。采用自由词与主题词相结合的方式进行检索。英文检索词包括prostate cancer、prostate tumor、prostate neoplasms、prostate carcinoma、prostatic hyperplasia、HIF-1α 、HIF-1, 中文检索词包括前列腺癌、前列腺肿瘤、前列腺恶性肿瘤、前列腺增生、正常前列腺、缺氧诱导因子和低氧诱导因子等。
1.1.1 研究类型 国内外公开发表的HIF-1α 蛋白表达与前列腺癌及其临床特征和预后关系的研究, 包括队列研究和病例对照研究。
1.1.2 研究对象 所有病例均有完整临床病理资料, 全部病例均经病理证实, 取材前均未经放疗、化疗或其它肿瘤生物治疗, 所有病例均不受年龄限制。
1.1.3 暴露因素 病例组采用免疫组织化学染色法(IHC)检测HIF-1α , 评定标准根据细胞的染色程度同时采用半定量分析法。
1.1.4 结局指标 前列腺癌的发病风险, 包括无进展生存时间(progression-free survival, PFS)和无转移生存时间(metastasis-free survival, MFS)。
1.1.5 排除标准 ①HIF-1α 检测方法为非免疫组化法且阳性判断标准不一致者; ②质量较差等无法提取相关数据的文献; ③会议记录、文献综述、评论等。
①由2位研究者分别根据纳入与排除标准进行文献初筛, 然后交叉核对, 如存在分歧则讨论解决。②文献的提取内容包括第一作者、发表年限、国家、年龄范围、样本量大小、临床病理特点等。③采用观察性研究偏倚风险的评估工具NOS量表对纳入研究的方法学质量进行评价。从病例-对照的选择、可比性、暴露信息三个方面对文献质量评分(当评分0~4时, 说明质量较低; 当评分为5~9时, 说明质量较高)。
采用RevMan 5.3 软件进行Meta分析, 以风险比(hazard ratio, HR)和优势比(odds ratio, OR)及其95%可信区间(confidence interval, CI)为效应统计量。首先采用χ 2检验对各纳入研究结果进行异质性检验, 检验水准为α =0.1。如果P≥ 0.1且I2≤ 50%, 说明多个同类研究结果间具有同质性, 应采用固定效应模型进行Meta分析; 如果P< 0.1但I2≤ 50%, 说明各研究结果间存在低度异质性, 应采用固定效应模型进行Meta分析; 如果P< 0.1且I2> 50%, 说明各研究结果间具有较大异质性, 应先分析异质性的可能原因, 排除研究设计缺陷、临床异质性等问题后采用随机效应模型进行Meta分析。
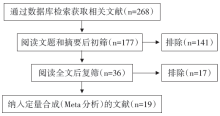
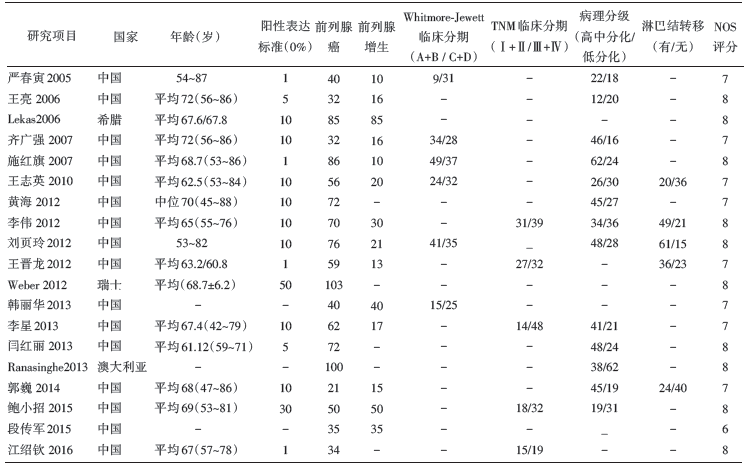
初检出相关文献268篇, 经逐层筛选后, 最终纳入19篇文献[7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25], 其中中文16篇, 英文3篇, 文献筛选流程及结果见图1。纳入研究的基本情况与质量评价见表1, 共1 503例患者, 其中1 125例前列腺癌、378例良性前列腺增生。
| 表1 纳入研究的基本特征 |
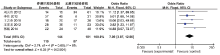
2.2.1 HIF-1α 蛋白表达水平 共13个研究报告了前列腺癌组与前列腺增生组的HIF-1α 蛋白表达水平, 其中前列腺癌组777例, 前列腺增生组337例。固定效应模型Meta分析结果显示, 前列腺癌组HIF-1α 蛋白表达水平明显高于前列腺增生组, 其差异有统计学意义(OR=14.30, 95%CI 7.41~27.60, P< 0.000 01), 见图2。
2.2.2 Whitmore-Jewett临床分期 共5个研究报告了前列腺癌不同Whitmore-Jewett临床分期的HIF-1α 蛋白表达水平, 其中A+B组163例, C+D组157例。固定效应模型Meta分析结果显示, 临床C+D组的HIF-1α 蛋白表达水平明显高于临床A+B组, 其差异有统计学意义(OR=8.51, 95%CI 4.90~14.80, P< 0.000 01), 见图3。
2.2.3 TNM临床分期 共5个研究报告了前列腺癌不同TNM临床分期的HIF-1α 蛋白表达水平, 其中Ⅰ +Ⅱ 组105例, Ⅲ +Ⅳ 组170例。固定效应模型Meta分析结果显示, Ⅲ +Ⅳ 组的HIF-1α 蛋白表达水平明显高于Ⅰ +Ⅱ 组, 其差异有统计学意义(OR=4.93, 95%CI 2.84~8.57, P< 0.000 01), 见图4。
2.2.4 病理分级 共11个研究报告了前列腺癌不同病理分级HIF-1α 蛋白的表达水平, 其中高中分化组436例, 低分化组274例。固定效应模型Meta分析结果显示, 前列腺癌低分化组的HIF-1α 蛋白表达水平高于前列腺癌高中分化组, 其差异有统计学意义(OR=5.53, 95%CI 3.74~8.18, P< 0.000 01), 见图5。
2.2.5 淋巴结转移 共5个研究报告了前列腺癌伴淋巴结转移组与前列腺癌无淋巴结转移组的HIF-1α 蛋白表达水平, 其中伴淋巴结转移组144例, 无淋巴结转移组181例。固定效应模型Meta分析结果显示, 伴淋巴结转移组HIF-1α 蛋白表达水平低于无淋巴结转移组, 其差异有统计学意义(OR=7.09, 95%CI 3.87~12.98, P< 0.000 01), 见图6。
2.2.6 年龄 共3个研究报告了前列腺癌年龄> 65岁组与≤ 65岁组的HIF-1α 蛋白表达水平, 其中> 65岁组99例, ≤ 65岁组64例。固定效应模型Meta分析结果显示, 两组HIF-1α 蛋白表达水平差异无统计学意义(OR=1.66, 95%CI 0.86~3.20, P=0.13), 见图7。
2.2.7 预后 1个研究报道了HIF-1α 蛋白表达水平对前列腺癌无进展生存时间的影响, 共纳入了103例前列腺癌患者, 固定效应模型Meta分析结果显示, 过表达的HIF-1α 蛋白水平预示前列腺癌患者更短的无进展生存时间, 其差异有统计学意义(HR=0.37, 95%CI 0.17~0.81, P=0.01)。另1个研究报道了HIF-1α 蛋白表达水平对前列腺癌无转移生存时间的影响, 共纳入了100例前列腺癌患者, 固定效应模型Meta分析结果显示, 过表达的HIF-1α 蛋白水平也提示前列腺癌患者更短的生存时间, 其差异有统计学意义(HR=9.80, 95%CI 1.50~63.86, P=0.02)。
缺氧诱导因子-1α ( HIF-1α )作为一种转录因子, 参与细胞低氧适应、血管生成、免疫应答、细胞凋亡等多种反应[26]。近年来的研究结果表明HIF-1α 可在转录、翻译、蛋白质的稳定性三个方面, 通过基因扩增、单核基因多态性等方式, 提升HIF-1α mRNA的表达水平, 缩短HIF-1α 亚型的表达, 使自身在前列腺癌中稳定高表达[27]。另有研究发现HIF-1α 在前列腺癌中的高表达水平受到前列腺癌Notch、AR、PI3K/Akt/mTOR等信号通路的调控, 对前列腺癌的发生、发展及疾病预后产生重要的影响, 这也为我们在前列腺癌分子信号转导通路的靶向治疗提供更多客观依据[28, 29]。此外, HIF-1α 还可以诱导肿瘤细胞对放化疗产生耐受, 当HIF-1α 的表达水平越高时, 患者在接受手术、放化疗、激素等治疗后复发的时间越短[21, 22, 23, 24, 25, 26, 27, 28, 29, 30]。这说明HIF-1α 可能作为前列腺癌临床预后的一个潜在指标。
本Meta分析结果显示:前列腺癌组的HIF-1α 蛋白表达水平显著高于前列腺增生组, 提示HIF-1α 蛋白表达水平升高会增加罹患前列腺癌的风险; 在前列腺癌不同临床病理特征中, HIF-1α 蛋白表达水平在高中分化组明显低于低分化组, 提示HIF-1α 蛋白表达水平升高会增加前列腺癌低分化水平; 在前列腺癌不同临床Whitmore-Jewett和TNM分期中, 它们有着相同的结果, HIF-1α 蛋白表达水平与临床分期成正相关。同时, 伴有淋巴结转移的前列腺癌患者HIF-1α 蛋白表达水平显著高于无淋巴结转移者, 提示HIF-1α 蛋白表达水平升高对前列腺癌淋巴结转移有促进作用。HIF-1α 蛋白过表达预示着前列腺癌患者有更加低的无进展和无转移生存率, 提示HIF-1α 在前列腺癌是一个不良的预后指标。
本研究的局限性:纳入研究数量(19个)较少, 样本量均偏少, 部分指标的合并分析纳入研究数仅3个, 样本量仅几十例, 很难控制各种偏倚因素, 可能降低了本次分析结果的可靠性; 其次HIF-1α 蛋白表达水平与前列腺癌相关的大多数文献无法获取临床病理及预后的相关数据, 或前列腺的检测方法为PCR(但其结果与本研究相符, 提示HIF-1α 蛋白在前列腺癌组织中的阳性表达率较对照组高), 与本研究纳入标准不符, 故本次Meta分析纳入研究数量受限。
综上所述, 本文研究表明HIF-1α 蛋白表达与前列腺癌及其不同临床病理特征存在显著相关性, 并影响着前列腺癌患者的预后, 提示HIF-1α 蛋白在前列腺癌的发生、发展过程中可能发挥重要作用。因此, 本系统评价可能更加准确地丰富了前列腺癌发病机制的研究, 为前列腺癌的筛查提供新途径, 并为前列腺癌的基因治疗提供新靶点。但受纳入研究数量和质量限制, 目前尚不能将其作为判定前列腺癌预后的独立因素, 尚需开展更高质量研究加以验证。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|