陆舜教授,临床医学博士,主任医师,博士研究生导师(国务院特殊津贴获得者)。上海市肺部肿瘤临床医学中心主任。参加及承担国家和上海市科研基金项目10项。其中国家级课题为:2016年作为第一负责人承担科技部“重大慢性非传染性疾病防控研究”重点专项—基于组学特征的肺癌免疫治疗疗效预测指标的构建和验证;2016年作为第一负责人承担国家自然科学基金 “外泌体miRNAs介导FGFR/GLI2信号通路调控肺鳞癌干细胞表型及侵袭转移的分子机制”;2012年作为第一负责人承担科技部国际合作课题“中瑞合作肺癌临床医学中心肺癌诊治关键技术转化医学研究”。2007年与2012年均作为第一负责人承担国家863重大课题“肺癌的分子分型和个体化诊疗”的子课题;2007年参与承担国家十一五科技支撑计划课题。至2016年作为主要研究者之一参与或承担30余项国际国内多中心随机对照临床研究。2010年获得上海市医学领军人才。2013年获得上海市优秀学术带头人称号。2013年作为第一负责人获得上海市医学科技奖三等奖。
作为第一通讯作者发表论文及论著100余篇,其中SCI收录45篇,包括Chest、JTO、PLoS One、Oncoltarget等知名杂志,总IF 121.8。参加多项专著的编写工作。曾担任美国临床肿瘤学会(ASCO)国际事务部委员,中华医学会肿瘤学会委员、上海市医学会肿瘤靶分子学会委员;目前担任ASCO多学科诊治小组(MCMC)成员,国际肺癌研究会(IASLC)组织委员会委员,国际肺癌研究会官方杂志Journal of Thoracic Oncology副主编,The Oncologist杂志编委,中国抗癌协会肺癌专业委员会候任主任委员,中华医学会肿瘤学会胸部肿瘤组组长。Reck M, Rodrí guez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375(19):1823-1833.
1b。
Ⅰ 期临床试验 KEYNOTE-001和Ⅲ 期临床试验KEYNOTE-003的数据表明:程序性死亡配体-1(programmed death ligand 1, PD-L1)表达比例≥ 50%的晚期非小细胞肺癌患者较PD-L1低表达的患者更可能对Pembrolizumab治疗产生应答。Pembrolizumab是一个高选择性的人源性抗程序性死亡-1(programmed death 1, PD-1)单克隆抗体, 它阻断PD-1与PD-L1、PD-L2的结合。
对于没有EGFR、ALK等驱动基因的非小细胞肺癌患者来说, 其治疗选择局限于化疗。KEYNOTE-001 研究显示Pembrolizumab在PD-L1表达比例≥ 50%的晚期非小细胞肺癌患者一线治疗中, 疾病反应率为58.3%, 中位无进展生存期可达12.5个月, 2年生存率为60.6%。
比较Pembrolizumab与含铂化疗在PD-L1表达比例≥ 50%的晚期非小细胞肺癌患者中一线治疗的疗效和安全性。
• 研究条件:前瞻性, 多国家、多中心参与, Ⅲ 期随机对照临床试验(KEYNOTE-024)。
• 研究起止时间:2014年8月至2016年5月。
• 研究对象: 年龄≥ 18岁, Ⅳ 期初治的非小细胞肺癌患者, EGFR野生型且ALK阴性, ECOG PS评分0或1分, 可测量病灶≥ 1个, 预期生存时间≥ 3个月, 肿瘤PD-L1表达比例≥ 50%。根据PS评分(0 vs. 1)、病理亚型(腺癌vs. 鳞癌)和地域因素(东亚vs.非东亚)分层。
• 干预措施:305 名患者进行随机分组, 154名患者接受Pembrolizumab 治疗, 200 mg/次, 每3周为1 疗程; 151 名患者接受含铂方案化疗(最常用方案为培美曲塞联合顺铂, 或吉西他滨/紫杉醇联合顺铂), 每3周为1 疗程。
• 评价指标:主要研究终点指标为无进展生存期, 次要终点指标包括:总生存期、客观缓解率以及安全性。
305名患者随机入组, 其中154名患者进入Pembrolizumab组, 151名进入化疗组, 中位随访时间为11.2个月, 最短6.3个月。两组间的人口统计学及临床特征总体均衡性较好, 但化疗组较Pembrolizumab组非吸烟者多(12.6% vs. 3.2%), Pembrolizumab组则较化疗组脑转移患者更多(11.7% vs. 6.6%)。
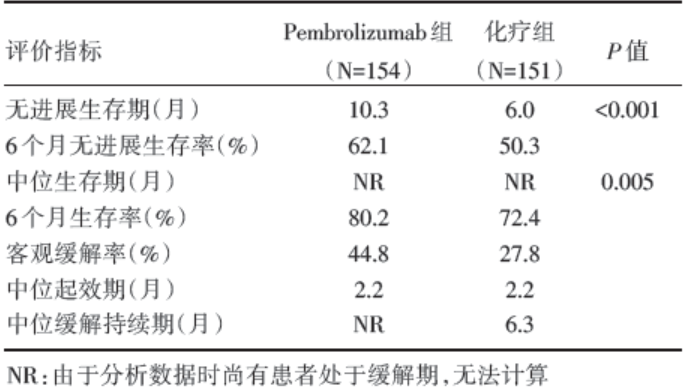
Pembrolizumab 组和化疗组无进展生存期分别是10.3个月和6.0个月, 差异有统计学意义(P< 0.001)。Pembrolizumab 组和化疗组的客观缓解率分别为44.8%和27.8%, Pembrolizumab 组客观缓解率高于化疗组。Pembrolizumab 组和化疗组的6个月生存率分别为80.2%和72.4%, 两组的中位生存期均未达到, 但 Pembrolizumab 组长于化疗组, 差异有统计学意义(P=0.005), 具体见表1。
| 表1 Pembrolizumab 组与化疗组的疗效比较 |
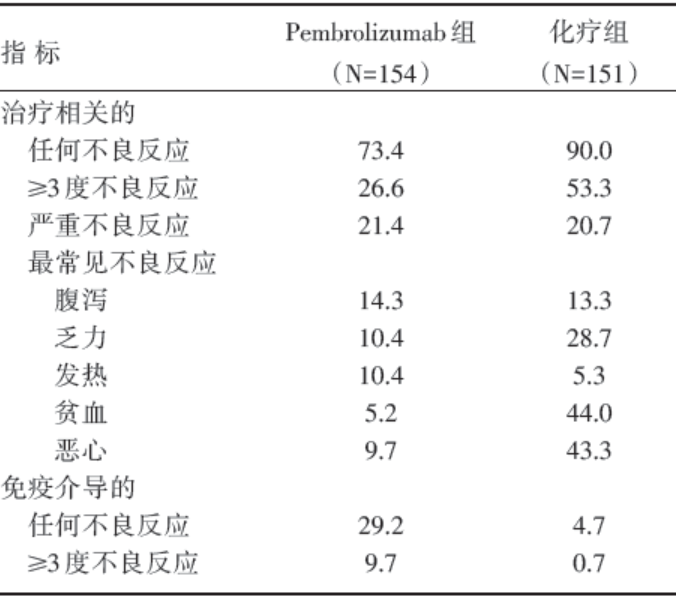
Pembrolizumab 组治疗相关的不良事件(73.4% vs. 90.0%)和3度以上不良事件发生率(26.6% vs. 53.3%)均低于化疗组。Pembrolizumab 组与化疗组严重不良事件发生率(21.4% vs. 20.7%)相当。见表2。Pembrolizumab 组因不良事件终止研究的发生率(7.1% vs. 10.7%)低于化疗组。治疗相关性死亡事件在两组分别是1例(Pembrolizumab 组)和3 例(化疗组)。
Pembrolizumab 组最常见的不良事件报告包括腹泻(14.3%)、乏力(10.4%)以及发热(10.4%)。化疗组最常见的不良事件报告包括贫血(44.0%)、恶心(43.3%)和乏力(28.7%)。
Pembrolizumab 组免疫介导的不良事件(29.2% vs. 4.7%)及3度以上不良事件发生率(9.7% vs. 0.7%)均高于化疗组。Pembrolizumab 组中发生的2例≥ 3度不良反应分别为严重皮疹(3.9%)、肺炎(2.6%)及结肠炎(1.3%)。无5度不良事件发生。
| 表2 Pembrolizumab 组与化疗组的不良事件比较 % |
对于PD-L1表达比例≥ 50%的晚期非小细胞肺癌患者, Pembrolizumab较以铂类为基础的联合化疗显著改善无进展生存期和总生存期, 且不良事件更少。
2016年10月9日新英格兰医学杂志刊登了默沙东公司的Pembrolizumab在KEYNOTE-024临床试验中的结果。在305例PD-L1表达水平不低于肿瘤细胞数量50%且不伴有EGFR基因突变或ALK基因融合的晚期非小细胞肺癌中, 一线使用Pembrolizumab 相比化疗, 客观缓解率更高(44.8% vs. 27.8%); 无进展生存期更长, 延长了4.3个月(10.3个月vs. 6.0个月, 风险比0.50, 95%可信区间0.37~0.68, P< 0.001); 总生存率更高, 6个月的总生存率分别为80.2% 和72.4%(风险比0.60, 95%可信区间0.41~0.89, P=0.005); 安全性更高, 治疗相关不良事件发生率更低(73.4% vs. 90.0%), 严重不良事件发生率也更低(26.6% vs. 53.3%)。
该临床试验的主要研究依据包括:(1)根据Pembrolizumab在Ⅰ 期KEYNOTE-001和Ⅲ 期KEYNOTE-010两个临床试验的结果, 选择肿瘤细胞PD-L1表达水平不低于肿瘤细胞数量50%的患者; (2)根据前期的研究确定Pembrolizumab的治疗剂量为200 mg q3w; (3)该研究排除了EGFR基因突变/ALK基因融合阳性患者, 这部分患者一线用药应为靶向治疗而非化疗, 最新的回顾性分析提示EGFR基因突变/ALK基因融合阳性可能与免疫治疗的低反应率有关[1] 。
该项研究取得成功, 基于无进展生存期的亚组分析, 各亚组中Pembrolizumab的疗效均优于化疗, 且独立于年龄、性别、PS评分、肿瘤组织类型、种族、基线脑转移发生率、化疗方案和吸烟状态等因素。然而, 研究仍存在一些不足:(1)研究同时纳入肺腺癌(82%)和肺鳞癌(18%)患者, 尽管结果显示Pembrolizumab在不同病理类型的患者中疗效均优于化疗, 考虑肿瘤组织学上的差异以及化疗在不同病理类型的患者中疗效差别较大, 未来有必要进一步明确Pembrolizumab在两种不同病理类型患者中的疗效差异; (2)目前依然无法明确超过35周期后, 继续使用Pembrolizumab能否进一步获益; (3)目前尚不能明确PD-L1表达水平界限值在50%以下的人群使用Pembrolizumab的获益情况, 未来PD-L1强阳性的界限值到底是多少为好?(4)尚且不能明确PD-L1表达水平在病程中的动态变化过程。
在临床实践上, 我们需要关注:(1)研究采用Dako公司的22C3抗体分析, 与其他免疫药物选用的PD-L1检测抗体测试结果的兼容性问题有待进一步明确[2], 这关系到有限的病理标本的送检策略; (2)该研究仅限于指导Pembrolizumab在高表达PD-L1(肿瘤细胞数量50%以上)且无EGFR基因突变/ALK基因融合晚期非小细胞肺癌患者中的使用; (3)研究纳入人群中仅13%是东亚人群, 东亚人群使用Pembrolizumab的疗效与KEYNOTE-024的研究结果是否一致不能完全肯定; (4)Pembrolizumab相比化疗在不良事件谱上的变化, 更低的骨髓抑制和更高的免疫相关不良反应, 包括甲状腺疾病(甲状腺功能亢进、甲状腺功能减低、亚急性甲状腺炎等)、皮肤黏膜相关不良反应、免疫相关肺炎及消化道内分泌系统相关的不良事件, 应注意用药时不良事件的管理[3], 特别是激素在控制合并症和免疫相关不良事件中的应用; (5)作为结核和乙肝高发的国家, 在伴有这类疾病的患者中使用Pembrolizumab的效果和安全性尚不明确。
基于驱动基因的靶向治疗为肺腺癌的治疗带来重大变革, 而鳞癌的靶向治疗进展相对滞后。免疫治疗方兴未艾, 为肺癌患者带来新的希望。KEYNOTE-024研究确立了免疫治疗在不伴随驱动基因且高表达PD-L1的晚期非小细胞肺癌一线治疗中的价值, 至今尚有许多关于免疫治疗的问题需要更深层次的探索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|