刘晓晴,解放军第307医院全军肿瘤中心肺部肿瘤科主任医师、教授、博士研究生导师。从事肺癌的放疗、化疗及靶向生物综合治疗,肺癌个体化治疗的基础和临床研究。承担国家科技部重大专项、首都医学发展基金、首都临床特色医疗等课题。近5年以通讯作者(第一作者)在国内外专业期刊发表论文100余篇,参编著书10部。获得国家科学技术一等奖1项、军队医疗成果一等奖2项、华夏医学二等奖1项。参与国家卫计委《原发性肺癌诊疗规范》(2015年版), 中国晚期原发性肺癌诊疗专家共识 (2016年版) ,中国表皮生长因子受体基因突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南, 肿瘤相关性贫血临床实践指南等的制定。
目前担任中国临床肿瘤学会理事会理事,中国抗癌协会化疗专业委员会委员,中国临床肿瘤学会小细胞肺癌专家委员会副主任委员、精准医学与肿瘤康复专业委员会副主任委员,中国老年肿瘤专业委员会肺癌分委会常委,中国药学会抗肿瘤药物专业委员会委员,中国医疗保健国际交流促进会胸部肿瘤分会常委,中国临床肿瘤学会肿瘤相关贫血专家委员会委员,全军放射肿瘤治疗学专业委员会委员,中国临床肿瘤学会肿瘤生物标志物专家委员会委员。《中国肺癌杂志》、《临床肿瘤学杂志》、《国际肿瘤学杂志》、《肿瘤研究与临床》、《临床防治与研究》、《临床肿瘤学论坛》、《肿瘤医学论坛》、JTO中文版杂志编委。
Tran E, Robbins PF, Lu YC, et al. T-cell transfer therapy targeting mutant KRAS in cancer [J]. N Engl J Med, 2016, 375(23): 2255-2262.
4。
• 过继免疫细胞具有一定的抗肿瘤作用, 可能的原因是T细胞具有特异性识别肿瘤抗原表位的免疫活性;
• G12D是KRAS基因最常见的突变位点, 目前尚缺乏针对KRAS G12D 突变蛋白有效的抗肿瘤药物或者疫苗。
报道1例转移性结肠癌患者, 接受靶向KRAS G12D突变T细胞免疫治疗的疗效及伴随的临床特点和生物学发现。
• 研究条件:美国马里兰州贝塞斯达国立卫生研究院、国家癌症研究所研究项目(NCT01174121)。使用肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)免疫治疗转移性癌症患者的Ⅱ 期临床试验。
• 研究方法:个案报道。
• 研究时间:2010年7月31日启动的在研Ⅱ 期临床试验。
• 研究对象:验证靶向个体化肿瘤抗原表位的T细胞过继免疫治疗在转移性实体瘤中是否具有抗肿瘤活性的Ⅱ 期临床试验中的1名受试者。
• 干预措施:患者接受靶向KRAS G12D突变抗原表位的T淋巴细胞过继免疫治疗。
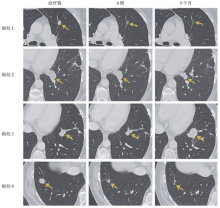
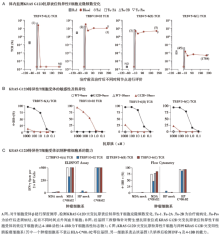
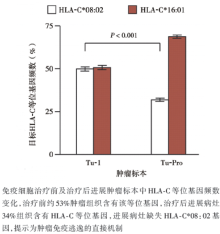
筛选出针对KRAS G12D突变靶点的TIL, 采用流式细胞技术分析回输产品中TIL的细胞毒性, 见图1。扩增后回输患者, 于治疗前及治疗后评价疗效的时间节点对肺部转移灶行疗效评价(见图2)。对靶向G12D抗原表位的T细胞计数、活性、敏感性及特异性进行评价, 输注免疫细胞后体内KRAS G12D突变抗原特异性T细胞克隆的持续性及活性见图3。患者肿瘤标本中HLA-C等位基因频数变化见图4。
对于存在KRAS G12D突变及表达HLA-C* 08:02肿瘤组织, 靶向突变KRAS抗原表位T细胞过继免疫治疗可引起有效的抗肿瘤免疫反应。
肿瘤过继细胞治疗(adoptive cell therapy, ACT)是通过对自体免疫细胞进行体外激活和扩增, 然后将其重新输回肿瘤患者体内, 并辅以合适的生长因子, 促使其在体内发挥杀伤肿瘤细胞的作用。自1985年Rosenberg等首次应用ACT方法治疗黑素瘤以来, 肿瘤ACT虽有进展, 但一直成效不佳。我国在1990年前后曾一度兴起应用淋巴因子激活的杀伤细胞(lymphokine activated killer cell, LAK)治疗肿瘤的热潮, 但终因该方法涉及大剂量IL-2的使用, 毒性较大且临床疗效不明确, 逐渐退出临床治疗, 目前仅有少数机构继续应用, 没有成为肿瘤治疗的主流方法。近年来, 随着肿瘤ACT取得长足进步以及免疫检测点抑制剂(PD-1/PD-L1、CTLA-4)治疗肿瘤的成功, 免疫治疗又掀起一个新高潮并进入一个全新阶段。
ACT技术中两大最新的免疫细胞技术包括嵌合抗原受体(chimeric antigen receptors, CAR)T细胞技术(CAR-T)以及T细胞受体(T cell receptor, TCR)嵌合型T细胞(TCR-T), 因其能够表达特异性受体靶向识别特异性的肿瘤细胞而受到广泛的关注和研究, 近年来已从最开始的基础免疫研究转变为临床应用。跟CAR-T相比, TCR-T技术已有初步的实体瘤临床数据了, 且获得了FDA的突破性药物地位。
已明确超过30%的人类肿瘤是由于RAS基因家族突变所造成。RAS基因突变包含KRAS、NRAS和HRAS等。大部分KRAS突变为热点驱动突变, 其位于密码子12、13、16, 其中密码子12是最常见的突变位点。在该位点的密码子G转变为D产生了KRAS G12D突变, 在大约45%的胰腺癌及13%的结肠癌中均存在。尽管进行了大量RAS基因突变为靶点的治疗研究, 但直到目前收效甚微。Rosenberg首次在1例转移性结直肠癌患者治疗中证实:靶向突变型KRAS G12D的CD8+T细胞输注治疗KRAS G12D 和 HLA- C* 08:02分子表达的直肠癌患者效果显著[1]。
该项研究的意义和价值:
(1)KRAS G12D突变是多种肿瘤的驱动基因, 目前针对此靶点的治疗疗效仍不理想。该项研究首次证明了过继回输针对患者自体肿瘤突变新抗原的TIL能够对表达该类抗原的肿瘤细胞产生明显的抗肿瘤反应, 因而开启了对表达这种突变其它肿瘤进行特异性T细胞受体基因重组治疗的可能性, 这将为KRAS突变肿瘤提供一种新的有效治疗手段。
(2)为处于探索之中的CAR-T治疗实体瘤带来了新的启发。从理论的角度证实了肿瘤新生抗原或特异性抗原受体作为肿瘤过继性细胞治疗靶点的可行性和优势, 这种理论的验证所产生的后续效应不可估量。
该项研究的亮点:
(1) 这是一项主要基于理论的验证性研究, 设计严谨细致、科学合理; 试验方法技术(TCR-T)采用了目前过继性T细胞免疫治疗的先进技术和理念。
(2)非拘泥于药物临床试验的常规。此个案来自于一项正在进行的前瞻性Ⅱ 期临床试验(ClinicalTrials.gov number, NCT01174121)[2], 该试验是用来验证体外扩增含有靶向个体肿瘤新表位的肿瘤浸润性淋巴细胞是否介导了实体瘤的缓解。虽然在12例患者中仅观察到了1例转移性结肠癌患者在接受特异靶向KRAS G12D的过继性T细胞治疗后出现缓解, 但此个案的成功却验证了一个重要理论和机制, 具有非凡意义和启示作用[3]!
(3)进一步对一个进展病灶进行全外显子及转录组测序, 表明进展肿瘤仍然表达KRAS G12D突变, 但其中编码HLA-C* 08:02等位基因的6号染色体拷贝丢失。这个现象表明疾病的进展并不是因为靶向抗原的缺失, 而是KRAS G12D反应性T细胞识别所必须的HLA限制性元件缺失, 这一结果的发现不仅解释了肿瘤组织实现免疫逃逸的可能机制, 亦为未来克服免疫逃逸奠定了理论基础。
局限和不足:
(1)从技术上考虑, 该项研究采用了TCR-T技术, TIL治疗是HLA限制性的。在这个案例中, HLA-C* 08:02限制性T细胞获得了成功, 但一方面肿瘤细胞下调或者丢失该基因导致了治疗逃逸, 致疗效持续时间有限; 另一方面缺乏丰富的HLA-C* 08:02限制性T细胞的患者则无法受益。该项临床试验中入组了12名直肠癌转移患者, 只有这名4095号患者取得疗效, 因此后续需要开发新的其它HLA限制性抗原多肽。所以从Rosenberg博士的这项研究来反观CAR-T细胞治疗技术, 可以发现CAR-T治疗实体瘤具有现实性和可能性。因为CAR-T治疗中的一大特点就是克服了HLA的限制, 也克服了TIL制备的困难, 因为临床上可以提供TIL的患者数量十分有限, 特别是当患者经过了多线反复治疗后。当然, CAR-T面临的最大问题之一就是匮乏类似KRAS突变这类肿瘤特异性靶点, 这应该是CAR-T治疗实体肿瘤中必须首先克服的障碍。
(2)这项工作仅仅是在Ⅱ 期研究中的一个成功案例, 仅能说明其验证了一个原理, 理论贡献是主要的!未来还需要在其他肿瘤、更多患者中检验其临床疗效和安全性后, 才可以决定其在临床实践中的地位和未来。
肿瘤的ACT治疗经历了低迷状态后让我们重拾信心, 过继性T细胞转移靶向治疗KRAS G12D突变晚期肠癌患者的成功仅仅是个开始, 未来还需要在其他肿瘤、更多患者中检验其临床疗效和安全性后, 才可以决定其在临床实践中的地位和未来。另外涉及效应细胞分选、体外扩增、体外处理、回输等, ACT关键技术还需不断完善; 高免疫活性、效应细胞长期体内存活、高效富集、安全性这些问题的解决则仍需要更多探索及新技术助力。此外将免疫治疗与其它抗肿瘤治疗科学合理结合(与传统化疗、放疗、PD-1/PD-L1和CTLA-4抑制剂、抗血管生成治疗)对于其发挥最大疗效也至关重要。我们有理由相信, 在不久的将来免疫治疗将会在肿瘤治疗中获得更大的成功并真正成为一种重要治疗手段, 终将为肿瘤患者带来福音。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|