范云,主任医师,浙江省肿瘤医院胸部肿瘤内科病区主任。中国临床肿瘤学会(CSCO)理事,中国医促会胸部肿瘤分会常委,中国临床肿瘤学会小细胞肺癌专家委员会副主任委员,浙江省医学会肿瘤学分会常委,浙江省抗癌协会食管癌专业委员会副主任委员,浙江省抗癌协会抗癌药物及药理专业委员会副主任委员。主要研究方向为肺癌、食管癌的个体化治疗及转化性研究。主持国家自然科学基金、浙江省自然科学基金等科研项目多项,第一作者/通讯作者发表论文40余篇,其中SCI收录论文15篇。
Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and Pemetrexed with or without Pembrolizumab for advanced, non-squamous non-small-cell lung cancer: A randomised, phase 2 cohort of the open-label KEYNOTE-021 study[J]. Lancet Oncol, 2016, 17(11):1497-1508.
1b。
• 在以往的临床试验中, 单药PD-1抑制剂Pembrolizumab在晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)的治疗中已显示可喜的疗效。
• Pembrolizumab与化疗无重叠的不良反应。
• PD-1抑制剂Pembrolizumab联合标准化疗方案一线治疗晚期非鳞NSCLC的疗效尚未明确。
比较晚期非鳞NSCLC患者Pembrolizumab联合标准化疗(培美曲塞+卡铂)与单纯化疗(培美曲塞+卡铂)的疗效、安全性和不同PD-L1状态下患者的转归。
• 研究条件:美国和台湾的26个研究中心联合开展的KEYNOTE-021研究。
• 研究方法:多中心、随机、开放Ⅱ 期临床试验。
• 研究时间:2014年11月至2016年1月。
• 研究对象:Ⅲ B或Ⅳ 期、无EGFR突变及ALK易位的非鳞NSCLC初治患者。
• 评价指标:主要终点指标为客观缓解率(objective response rate, ORR), 次要终点指标为无进展生存期(progression-free survival, PFS)、总生存期(overall survival, OS)、安全性和不同PD-L1状态下患者的转归。
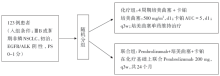
• 干预措施:患者按照1∶ 1的比例随机分为联合组或化疗组, 具体实施方案见图1。
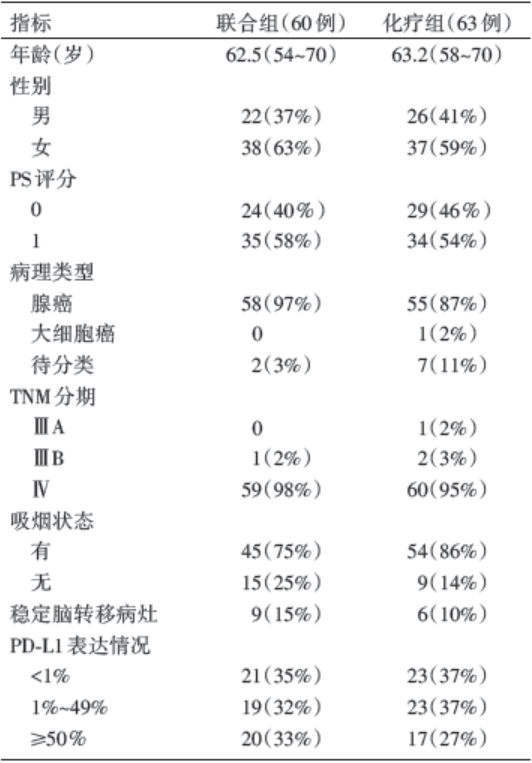
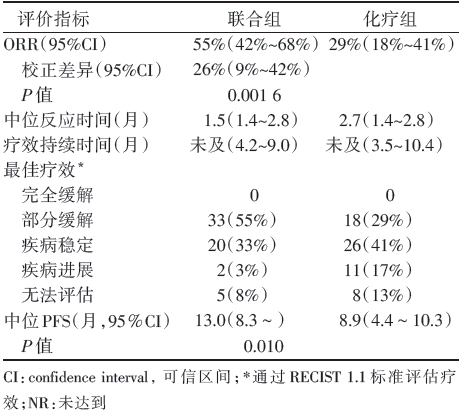
总共入组患者123例, 随机分配至联合组60例, 化疗组63例, 两组患者基线特征均衡(见表1)。截止至2016年8月8日, 中位随访时间为10.6个月, 目前随访工作仍在进行中。联合组中达到客观缓解的患者33例(55%), 而化疗组中仅为18例(29%), 而且两组患者疗效均能相当持续维持; 联合组相比化疗组能够显著延长PFS(13.0个月vs. 8.9个月, 风险比0.53, P=0.010), 见表2。而两组达到6个月OS的比例是相当的(均为92%), 联合组中, PD-L1表达在< 1%与≥ 1%两亚组的客观缓解率分别为57%和54%, 而在PD-L1表达≥ 1%的患者中, PD-L1表达1%~49%的19例, ≥ 50%的20例, 其客观缓解率分别为26%和50%。
| 表1 KEYNOTE-021 研究患者的基线水平及疾病特征 |
| 表2 KEYNOTE⁃021 研究的主要结果 |
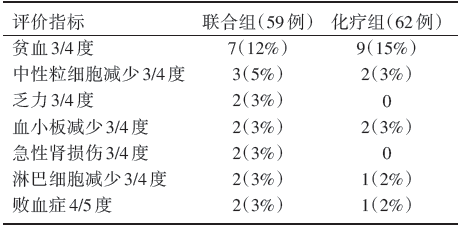
| 表3 KEYNOTE⁃021 试验的毒副反应 |
在毒性方面, 两组最常见的为贫血、中性粒细胞数减少及血小板减少等, 而联合组中淋巴细胞减少、乏力、败血症更为常见; 联合组1例患者死于败血症; 化疗组1例患者死于败血症, 1例死于全血细胞减少; 3度以上不良反应发生率两组类似(39% vs. 26%), 见表3。
在晚期非鳞NSCLC患者中一线应用Pembrolizumab联合标准化疗较单纯化疗组可取得更佳的ORR及PFS; 联合组毒副作用与化疗组无明显差异。
自上世纪70年代起, 含铂化疗一直是晚期NSCLC的标准一线治疗方案。尽管化疗的疗效有限且不良反应明显, 囿于治疗手段的匮乏, 对于野生型患者而言, 一线治疗并未获得突破性进展。直至2016年, 随着KEYNOTE-024研究结果的公布[1], 带来了晚期NSCLC的治疗革新。KEYNOTE-024研究显示在PD-L1表达≥ 50%的晚期NSCLC人群中, 相比含铂两药方案的一线化疗, Pembrolizumab治疗在ORR、PFS和OS上均获益, 并由此获得FDA批准。与此形成鲜明对比的是CheckMate 026研究[2], 这项研究以PD-L1表达≥ 5%作为目标人群的评价阈值, 结果提示Nivolumab与化疗相比未达到优效。是否在占比高达70%的PD-L1低表达或者不表达人群, PD-1/PD-L1抑制剂在一线治疗将就此失去机会。答案显然是否定的, 联合治疗为这类患者带来了希望, 其中主要是PD-1/PD-L1抑制剂与化疗或者是CTAL-4抑制剂的联合。
细胞毒药物具有多方面的正向免疫调节作用, 降低免疫抑制性细胞的数量和活性, 增加肿瘤抗原递呈, 激活和诱导树突状细胞成熟, 增强效应T细胞功能, 诱导肿瘤细胞PD-L1表达等。前期研究表明化疗联合PD-1/PD-L1抑制剂存在协同效应。KEYNOTE-021 G队列研究是一项Ⅱ 期的随机对照研究[3], 旨在未经化疗的晚期非鳞NSCLC患者中比较Pembrolizumab联合化疗(卡铂+培美曲塞)与单纯化疗的疗效, 筛选了219例患者, 123例患者可评价疗效, Pembrolizumab联合化疗相比单纯化疗明显提高ORR(55% vs. 29%, P=0.001 6), 显著延长PFS(13.0个月 vs. 8.9个月, P=0.01, 风险比0.53), 两组的OS无明显差异。联合治疗组≥ 3度的治疗相关不良反应发生率高于化疗组(39% vs. 26%), 总体不良反应可耐受, 不良反应谱可管理。
这是首个评价PD-1/PD-L1抑制剂联合化疗对比单纯化疗的Ⅱ 期随机对照研究; 与KEYNOTE-021 C队列研究中同样方案的单组治疗数据相比[4], ORR从71%下降到55%; 但与化疗组的ORR相比, 仍然达到了统计学意义上的差异。从横向进行比较, Nivolumab或者是 Atezolizumab联合含铂化疗的缓解率分别为47%和64%[5, 6]。这些Ⅰ 期研究的结果显示PD-1/PD-L1抑制剂联合化疗的近期疗效数据具有一定的可比性。目前, Pembrolizumab联合化疗已获FDA突破性治疗药物资格; 其他PD-1/PD-L1抑制剂联合化疗在晚期NSCLC的一线治疗中亦颇具竞争力。
除了联合化疗, 另一种引人关注的组合是PD-1/PD-L1抑制剂联合CTLA-4 抑制剂。临床前研究提示两者联合可放大Checkpoint的阻断作用, 在免疫微环境中, 充分恢复T细胞杀伤肿瘤细胞的效能。CheckMate 012研究为PD-1抑制剂与CTLA-4 抑制剂的联合治疗提供了初步数据[7]。CheckMate 012研究是一项多臂Ⅰ B期临床研究, 在不同方案中, 评价Nivolumab单药或者与Ipilimumab联合治疗未经化疗的晚期NSCLC患者, 联合治疗组总体ORR 43%, PFS为8.0个月; 在PD-L1≥ 1% 人群, ORR 57%, PFS达12.7个月; 在PD-L1≥ 50%亚组, ORR 高达92% , PFS 13.6个月。PD-1+CTLA-4 抑制剂的联合治疗模式同样给大家带来希望。
目前报道的免疫检查点抑制剂联合治疗的临床研究均为Ⅰ /Ⅱ 期, 普遍存在样本量小、随访期短、入组人群可能有选择偏倚等缺陷。基于前期研究的良好结果, 免疫检查点抑制剂联合治疗与含铂化疗的Ⅲ 期随机对照研究正在如火如荼地进行中; 如CheckMate 227研究、KEYNOTE-189研究、IMpower130研究, IMpower131研究、MYSTIC研究、NEPTUNE研究[8]。这些研究聚焦在晚期NSCLC的初诊患者, 选择不同的PD-L1 表达人群, 将回答PD-1/PD-L1抑制剂联合化疗或CTLA-4抑制剂作为一线治疗的可行性、适用人群及不同联合模式之间的差异性。
比起PD-1/PD-L1抑制剂的单药治疗, 联合治疗扩大了受益人群, 提高了疗效。但仍有许多问题亟待解决:最佳的联合搭档, 最合适的剂量分割, 不良反应的管理, 生物标志物的筛选, 药物经济学等等。可以预见, 一线Pembrolizumab治疗PD-L1高表达人群仅仅是即将来临的新的免疫治疗策略的前奏, 晚期NSCLC的治疗格局将会发生非常大的变化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|