胡毅教授,医学博士,博士研究生导师,中国人民解放军总医院肿瘤内一科行政主任。擅长于复杂疑难及急重症肿瘤的诊断救治,内科综合治疗经验丰富。获评解放军总医院首届“临床优秀医师”、首届“百位名医”、“百病妙诀”承担人。担任北京市乳腺病防治学会肿瘤免疫治疗专业委员会主任委员;中国研究型医院学会肿瘤学专业委员会副主任委员;担任中国临床肿瘤学会青年委员会副主任委员,肺癌组组长;全军医学科技委员会肿瘤专业委员会常委;中华医学会肿瘤分会青年委员;全国医师定期考核肿瘤专业编辑委员会委员,担任《国际肿瘤学杂志》、《中华实用医学杂志》等多本杂志的编委及审稿专家。以第一承担人承担国家自然科学基金课题3项,省部级课题10余项,第二承担人参与包括国家863重大课题2项,累计科研经费400余万元。第一完成人获多项成果奖,发
Gainor JF, Shaw AT, Sequist LV, et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: A retrospective analysis[J]. Clin Cancer Res, 2016, 22(18) :4585-4593.
2b。
目前数据显示非小细胞肺癌(non-small cell lung cancer, NSCLC)患者使用PD-1通路抑制剂的客观缓解率只有不到20%, 临床中迫切需要能更好地预测临床疗效的生物标志物, 以进一步划分可接受PD-1/PD-L1抑制剂治疗的患者。已知PD-1高表达与PD-1/PD-L1抑制剂客观缓解率(objective response rates, ORR)较高具有显著相关性。针对EGFR突变/ALK阳性患者一线靶向治疗毋庸置疑, 但耐药后的患者对治疗方案的选择十分有限, 这类患者使用PD-1/PD-L1抑制剂的临床疗效和TKI抑制剂对肿瘤组织PD-L1表达的影响目前尚未明确。
• 探讨EGFR突变/ALK阳性患者(与EGFR & ALK野生型相比)服用PD-1/PD-L1抑制剂的疗效;
• 探索EGFR/ALK-TKI治疗前后, EGFR突变/ALK阳性患者肿瘤微环境中PD-L1的表达水平和CD8+肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TILs)的浸润程度。
• 研究条件:哈佛大学医学院附属麻省总医院内科、病理科联合放疗科共同开展的回顾性研究, 所有患者数据均来源于哈佛大学医学院附属麻省总医院。
• 研究起止时间:收集2011年至2016年2月的患者数据分析PD-1通路抑制剂应答反应; 搜集2004-2015 年患者组织标本分析PD-L1表达水平。
• 研究对象:
(1)分析两组患者对PD-1通路抑制剂的应答情况:突变组为EGFR突变/ALK阳性、TKI耐药或获得性TKI耐药NSCLC患者, 既往接受过PD-1/PD-L1抑制剂治疗, 28例。对照组为EGFR& ALK均为野生型或者结果未知的NSCLC患者, 既往通过临床试验接受过单药PD-1/PD-L1抑制剂治疗, 30例。
(2)PD-L1表达水平分析: EGFR突变的患者68例, ALK阳性27例, 比较两组患者接受TKI治疗前后PD-L1表达水平和CD8+ TILs的浸润程度; 比较EGFR突变的患者和65例KRAS突变患者基线期(未接受PD-1/PD-L1治疗)PD-L1表达水平和CD8+TILs的浸润程度。
• 评价指标:(1)RECISTv1.1评估患者疗效, 分析两组患者对PD-1/PD-L1抑制剂的ORR和无进展生存期(progression-free survival, PFS)。(2)TKI治疗前后PD-L1的表达水平、CD8+TILs浸润程度(免疫组化半定量计分法和基于Imaging-Based的分析法两种方法)。
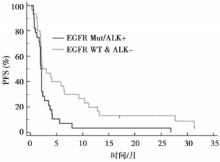
• EGFR突变/ALK阳性患者服用PD-1/PD-L1抑制剂后的ORR和中位PFS见表1。
| 表1 不同EGFR、ALK 基因状态患者服用PD-1/PD-L1 抑制剂的疗效 |
与野生型相比, 突变组患者ORR较低, 虽差异无统计学意义(P=0.053), 但已达到边缘状态。突变组患者有较短的中位PFS(P=0.018), 然而该数值并没有如其他PD-1/PD-L1抑制剂的研究在两个队列中获得显著差异, 通过生存曲线可清晰展示(风险比=0.515, P=0.018), 见图1。
与重度吸烟患者相比, 轻度吸烟患者的ORR较低(4.2% vs. 20.6%), 见表2。考虑到不吸烟与EGFR突变/ALK阳性有关, 本研究进行了亚组分析, 但受限于样本例数无法得出可靠的结论, 关于吸烟状态与EGFR和ALK的基因状态的关系, 有待于进一步研究。
| 表2 吸烟状态对PD-1/PD-L1 抑制剂抗肿瘤活性的影响 |
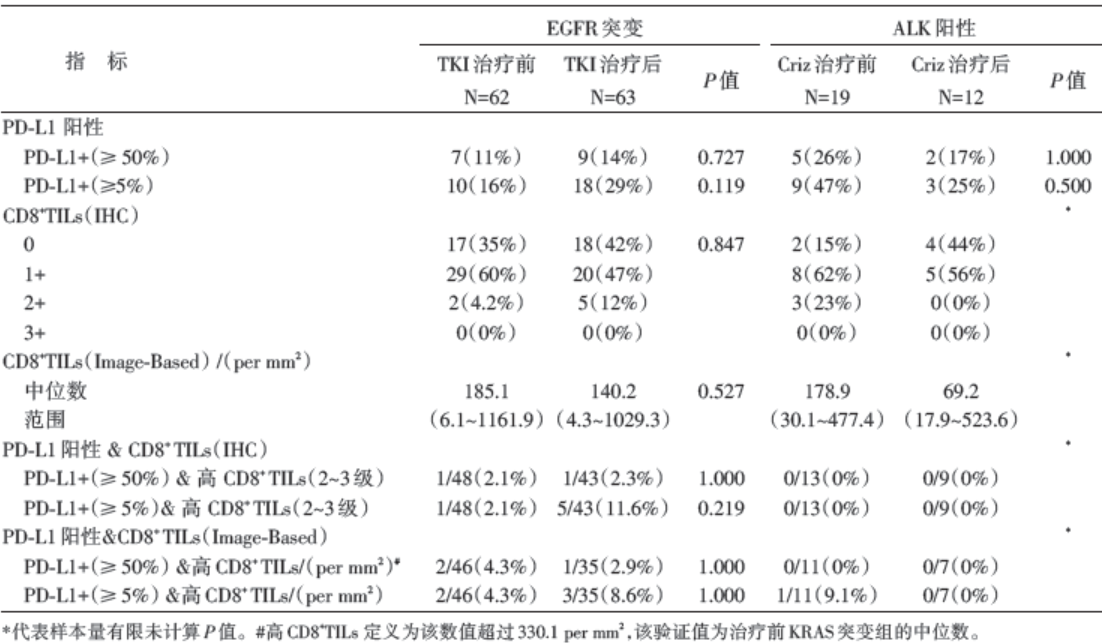
基于PD-1/PD-L1抑制剂在突变组(EGFR突变/ALK阳性)患者中表现出较低的抗肿瘤活性, 研究人员进一步分析了TKI治疗前后EGFR突变和ALK阳性患者的PD-L1表达水平和CD8+TILs浸润程度, 见表3。
| 表3 EGFR 突变/ALK 阳性患者TKI 治疗前后PD-L1 的表达水平 |
以往的几个临床报道均表明, EGFR突变和ALK阳性都与PD-L1的过表达有关, 这两组患者组织标本中有PD-L1染色的比例达到71.9%和78%。但本研究中突变组PD-L1表达水平较低, EGFR组:治疗前16%(PD-L1≥ 5%), 治疗后29%(PD-L1≥ 5%); ALK组:治疗前47%(PD-L1≥ 5%), 治疗后25%(PD-L1≥ 5%)。只有很少的EGFR突变和ALK阳性的患者展现出PD-L1与CD8+TILs的共表达。
EGFR突变患者和KRAS突变患者基线期PD-L1表达水平和CD8+TILs的浸润程度见表4。
• 非小细胞肺癌患者PD-1/PD-L1抑制剂客观缓解率低与EGFR突变或ALK阳性有关。
• 只有很少的EGFR突变和ALK阳性的患者展现出PD-L1表达与CD8+TILs的共存, 限制了PD-1/ PD-L1抑制剂的客观缓解率。
随着多个PD-1抑制剂在NSCLC临床研究中相继取得成功, 免疫治疗也终于在NSCLC中取得突破性的进步, 成为继靶向治疗之后的重要治疗手段。自然, 靶向治疗的获益人群和免疫治疗的获益人群之间的相关性也成为临床医生关注的焦点。此篇文章很好地着眼于该点, 回顾性地分析了EGFR敏感突变和ALK融合基因阳性人群及野生型或未知患者中PD-1抑制剂的疗效, 并分析了TKI治疗前后PD-L1表达水平的变化及CD8+TILs的变化。此研究正面回答了目前临床所关心的问题, 研究结果符合临床观察和预期的结果:野生型的患者从PD-1抑制剂中更能获得疗效。由于目前缺乏针对该问题的前瞻性研究数据, 回顾性的分析成为数据的主要来源, 虽然此研究入组的样本量较小, 在数据分析中容易造成明显偏倚, 但在目前现有的结果中, 初步反应了驱动基因阳性与免疫检查点抑制剂治疗的关系。针对本文的结论, 我们仍需要审慎地对待。
首先, 作为回顾性研究, 偏倚是不可避免的。由于突变阳性与野生型患者本身就是临床的不同亚型, 两组人群在年龄、性别、吸烟状况、病理组织学类型方面存在不同。已经证实的这些不同之处与PD-1抑制剂的疗效存在关联性, 如重度吸烟人群更能从PD-1抑制剂的治疗中获益更多。这些单因素造成的影响, 很难从小样本的回顾性研究中进行匹配消除。
其次, 两组人群的前期治疗情况不一致。突变组患者接受了中位三线方案的治疗, 而野生型的患者接受了中位二线方案的治疗; 野生型组均是参加临床研究的患者, 而突变组中有3例是自行用药的。在PD-1的临床研究中ECOG评分多数要求0~1分, 部分临床研究为0~2分。治疗上两组也存在不同, 突变组在治疗上有25%(7例)并非接受单纯的PD-1抑制剂治疗, 而在野生型患者均接受单药PD-1抑制剂的治疗。随着前期治疗的累积, 患者本身的体力状况因素、治疗选择及治疗耐受情况均存在不同, 可能会造成后续治疗有效率的不同。
再次, 两组在PD-L1的表达及CD8+TILs的阳性率上不同。EGFR突变和ALK阳性组中PD-L1和CD8+TILs共表达的比例明显低于KRAS突变组, 而在野生型组中有37%的患者存在KRAS的突变(11例)。PD-L1的表达及CD8+TILs共存目前认为是PD-1抑制剂的重要疗效标志物, 而无论是TKI治疗前还是TKI耐药后, PD-L1表达及CD8+TILs共表达的情况都十分罕见, 而这种PD-L1表达水平及CD8+TILs的不同势必影响后续治疗的疗效。同时突变组患者更多的是接受TKI的治疗, 而野生型组则更多地接受化疗, 已经有初步的数据提示化疗会影响肿瘤组织中CD8+TILs的变化, 导致肿瘤组织抗原的释放, 而TKI对CD8+TILs的影响尚未知, 前期治疗对后续PD-1抑制剂有效性的影响还需要进一步的研究。
总之, 该研究初步探索了NSCLC不同基因状况与PD-1抑制剂疗效之间的关系, 也反映出目前PD-1抑制剂治疗所面临的重要问题:我们仍然无法得知PD-1抑制剂的有效预测分子标志物, 所以我们仍需进一步的探索PD-1抑制的更准确的标志物, 才能真正筛选出获益人群。
The authors have declared that no competing interests exist.