宋勇,教授、主任医师。南京大学、第二军医大学、南方医科大学博士研究生导师。现任南京军区南京总医院呼吸和危重症医学科主任、肺癌综合诊治中心主任。全军呼吸内科专业委员会副主任委员、南京军区呼吸内科委员会主任委员、江苏省医学会呼吸分会副主任委员(兼肺癌学组组长)、中国临床肿瘤学会(CSCO)理事,中国抗癌协会肺癌专业委员会委员,国际肺癌研究会(IASLC)组织委员会委员。担任《Translational Lung Cancer Research》杂志主编,《Journal of Thoracic Disease》杂志和《Military Medical Research》杂志编委,以及《医学研究生学报》、《解放军医学杂志》、《中国肺癌杂志》、《中华肺部疾病杂志》等多本杂志的副主编和编委。主持和承担国家自然科学基金、国家新药基金、江苏省重点科研基金等多项基金资助的研究课题。以第一作者和通讯作者发表研究论著120余篇、SCI论文81篇,主编主译专著6本。以第一完成人获省部级和军队二等奖6项。被遴选为江苏省“333高层次培养人才”、南京军区“334领军人才培养对象 ”。荣立个人三等功2次,获江苏省医学重点人才、江苏省有突出贡献的中青年专家、南京军区科技英才、南京军区优秀科技人才津贴和中国呼吸医师奖等多项称号和奖励。
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus Docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): A randomised controlled trial[J]. Lancet, 2016, 387(10027):1540-1550.
1b。
• PD-1是一类表达于T细胞表面的共抑制信号分子, 其配体PD-L1表达于多种肿瘤细胞表面, PD-1与其配体PD-L1/PD-L2结合可介导免疫负性调节作用, 进而使肿瘤细胞逃避免疫细胞杀伤;
• CheckMate 017、CheckMate 057、POPLAR等临床研究均表明PD-L1抑制剂对晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)有较好的疗效。
评价Pembrolizumab在晚期PD-L1阳性经治NSCLC患者中的疗效及安全性。
• 研究条件:24个国家(阿根廷、澳大利亚、比利时、加拿大等)的202个医学研究中心参与的(KEYNOTE-010)研究。
• 研究方法:多中心、Ⅱ /Ⅲ 期、随机对照临床试验。
• 研究起止时间:2013年8月28日到2015年2月27日。
• 研究对象:患者的入组标准为:≥ 18周岁, ≥ 2周期含铂双药或TKI治疗后RECIST评价为疾病进展, 有可测量病灶, ECOG评分 0或1分, 有可检测的肿瘤组织标本, PD-L1 肿瘤比例分(tumour proportion score, TPS)≥ 1%。排除标准:既往接受过PD-L1抑制剂或多西紫杉醇治疗, 脑转移或脑膜转移, 合并自身免疫性疾病需服用类固醇, 间质性肺病, 应用类固醇治疗肺炎的既往史。
• 干预措施:符合入组条件的患者共1 034名, 随机分为三组, 分别接受2 mg/kg Pembrolizumab、10 mg/kg Pembrolizumab及多西紫杉醇治疗。流程见图1。
• 评价指标:主要终点指标为总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS); 次要终点指标包括安全性、有效率和应答持续时间。
共计1 034名PD-L1阳性且符合筛选标准的患者入组研究, 其中442名患者肿瘤细胞PD-L1表达超过50%, 中位随访时间13.1个月(最短随访期8.6个月)。基线特征森林图显示无论是在非选择抑或高选择的人群中, 除了EGFR突变患者无法在Pembrolizumab治疗中获益外, 余特征均倾向于Pembrolizumab组, 入组患者的临床特点见表1。
| 表1 入组患者的临床特点 |
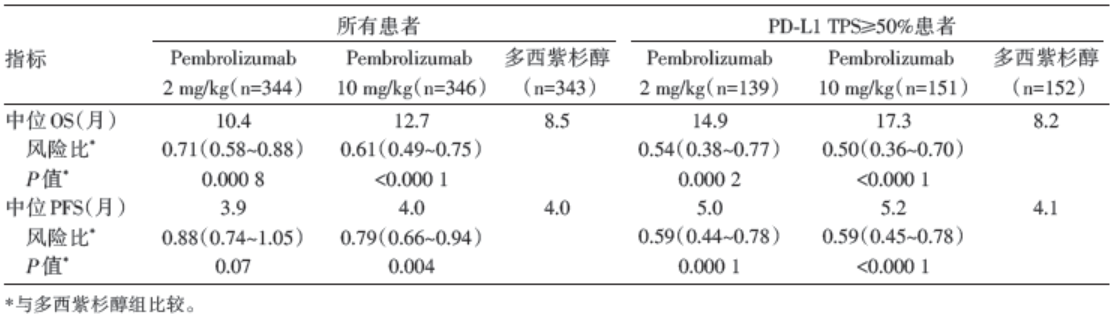
PD-L1 TPS≥ 50%患者中, Pembrolizumab 2 mg/kg组、Pembrolizumab 10 mg/kg组和多西紫杉醇组的中位OS分别为14.9个月、17.3个月和8.2个月, 无论是10 mg剂量组还是2 mg剂量组均较多西紫杉醇组OS延长。在非选择的PD-L1阳性患者中得到了相似的结果, 中位OS分别为10.4个月、12.7个月和8.5个月, OS同样较多西紫杉醇组延长, 具体见表2。中位PFS无论是在高选择PD-L1 TPS≥ 50%的患者还是非选择的PD-L1阳性患者, Pembrolizumab组和多西紫杉醇组均没有明显延长, 中位PFS分别为5个月、5.2个月、4.1个月和3.9个月、4个月、4个月。
| 表2 患者的OS 和PFS 分析 |
Pembrolizumab 2 mg/kg组最常见不良事件包括纳差(14%)、乏力(14%)以及恶心(11%), Pembrolizumab 10 mg/kg组常见不良事件为乏力(14%)、皮疹(13%)以及纳差(10%), 多西紫杉醇组最常见不良事件包括脱发(33%)、乏力(25%)以及腹泻(18%)。分别有15例(4%)和31例(10%)患者在2 mg/kg和10 mg/kg组因治疗相关不良事件终止研究。两组中的治疗相关死亡事件分别有3例, 2 mg/kg组分别为2例肺炎、1例实质性肺炎, 10 mg/kg组分别为1例心肌梗死、1例实质性肺炎和1例肺炎。
• Pembrolizumab可作为PD-L1阳性(TPS≥ 1%)晚期经治(二线或三线)NSCLC患者新的治疗选择。
• 鉴于两种剂量相似的临床获益, 推荐临床使用Pembrolizumab以2 mg/kg作为标准治疗剂量。
• 进一步证实PD-L1表达情况可作为Pembrolizumab的疗效预测指标。
针对免疫检查点(目前主要是PD-1和PD-L1)的免疫治疗是肺癌治疗历史上的一个关键重大突破。其主要机制是特异性地针对肿瘤微环境中关键免疫逃逸机制, 通过改善肿瘤免疫微环境来控制和清除肿瘤。 近年来多项研究结果均十分令人鼓舞, 多个药物被美国FDA和欧盟批准用于治疗NSCLC[1, 2]。2017年NCCN NSCLC指南更是基于新近发表的循证医学证据将PD-1和PD-L1单抗推荐为晚期NSCLC的一线和二线治疗方案。这些都意味着肺癌的治疗真正进入了免疫治疗时代。
2016年12月19日《柳叶刀》杂志上发表关于Pembrolizumab的一项Ⅱ /Ⅲ 期临床研究KEYNOTE-010的结果。该研究的目的就在于评价Pembrolizumab对晚期PD-L1阳性经治NSCLC患者的疗效及安全性。结果表明:对于PD-L1阳性的晚期NSCLC患者, Pembrolizumab比多西紫杉醇有更好的总生存获益。对于PD-L1强阳性的患者, 与多西紫杉醇相比, Pembrolizumab可以更好地改善OS和PFS。提示Pembrolizumab可作为PD-L1阳性(TPS≥ 1%)晚期经治(二线或三线)NSCLC新的治疗选择。和此前已经发表的关于PD-1单抗在晚期NSCLC患者治疗的临床研究相比, KEYNOTE-010研究具有以下特点:(1)入组患者并未考虑组织学类型, 而是将所有NSCLC人群纳入研究。前期发表的研究部分选择鳞癌和非鳞癌分别研究[3, 4], KEYNOTE-010研究结果表明Pembrolizumab对腺癌和鳞癌患者均有良好疗效和生存贡献。(2)该研究第一次在研究设计中将PD-L1阳性表达作为入组标准筛选病例。PD-L1作为疗效预测的Biomarker在这个研究中得到了很好的体现。在PD-L1 TPS≥ 50%患者中, Pembrolizumab 2 mg/kg组、Pembrolizumab 10 mg/kg组和多西紫杉醇组的中位OS分别为14.9个月、17.3个月和8.2个月, 无论是10 mg剂量组还是2 mg剂量组均较多西紫杉醇组OS延长。在非选择的PD-L1阳性患者中得到了相似的结果, 中位生存期分别为10.4个月、12.7个月和8.5个月, OS同样较多西紫杉醇组延长。该研究为肺癌的精准免疫治疗打下了坚实的循证医学基础。因为此项临床研究的成功, 2016年底Pembrolizumab通过FDA的加速审批程序, 获批治疗经治的所有组织学类型的PD-L1阳性NSCLC患者, 与该药一同获批的是一项伴随诊断(companion diagnostic)-PD-L1 IHC 22C3 pharmDx检测。(3)Pembrolizumab在NSCLC二线治疗的成功, 为免疫治疗在晚期NSCLC一线治疗中的探索开启了希望之门。2016年ESMO会议公布了KEYNOTE-024的研究结果, 表明Pembrolizumab一线单药治疗PD-L1高表达、晚期NSCLC患者的PFS、OS、总有效率均优于含铂两药化疗[5]。这一突破性的研究结果, 受到业界的极大关注。这些数据进一步支持Pembrolizumab成为PD-L1表达的晚期经治NSCLC患者的标准治疗方案。
在免疫治疗如火如荼的形势下, 如何能将这种突破性的治疗方法在晚期肺癌中精准应用、健康发展是我们目前亟待解决的问题。针对PD-1/PD-L1抗体的免疫治疗仍需进一步关注和解决如下问题:(1)如何选择合适的患者。目前已基本明确PD-L1表达可以作为疗效的预测标志物, KEYNOTE-024[5]和CheckMate 026不同的研究结果表明, 选择才是硬道理。但一些研究提示在二三线治疗非选择人群总体均获益, 不同公司的产品在不同的临床研究中所选择的PD-L1表达界值(cut off值)也不尽相同, 不同抗体(不同克隆号)得出的结果尽管有一定的指导意义, 但目前尚无任何一种抗体和方法被确定为标准。另外PD-L1在不同细胞群体的表达也和疗效存在一定的相关性。另外由于肿瘤的异质性、在治疗过程中免疫微环境的动态变化等因素普遍存在, 仅检测PD-L1表达难免会存在片面性。因此亟需探索和发现新的免疫治疗疗效预测Biomarker(s), 如肿瘤浸润淋巴细胞、突变负荷、基于外周血的Biomarker以及炎症信号分子等[6]。因此需要尽快对上述问题进行研究并制定出相应标准供临床使用, 这样才能真正将适合免疫治疗的患者群体筛选出来。(2)如何选择合适的剂量。KEYNOTE-010研究中Pembrolizumab所采用的剂量分别为2 mg/kg和10 mg/kg。结果显示均表现出明显的OS优势, 而且不同剂量组间没有区别。因此支持2 mg/kg每3周1次为理想的治疗剂量和方法。但不同的研究采用不同的产品和不同的剂量, 获得相近的结果[3, 4, 7, 8]。因此量效关系以及卫生经济学是选择合适剂量的重要因素。(3)如何确定合适的治疗时间。随着免疫治疗在晚期NSCLC临床研究的全面成功, 如何选择治疗时机, 是将其放在一线治疗还是二三线治疗是我们应该思考的问题。目前Pembrolizumab已被FDA批准作为PD-L1高表达(TPS≥ 50%)患者的一线治疗选择。但Pembrolizumab和其他产品也被批准为二三线治疗的标准。目前多数关于免疫检查点治疗的临床研究都是以病情进展或毒性不能耐受作为治疗终点。但部分探索性研究表明即使在疾病进展的患者继续给予免疫单抗仍可使部分患者带来生存获益。所以仍需探索并明确免疫检查点治疗的确切治疗周期和时间。尽管在中国已经开展多项相关研究, 但由于此类产品并未在中国大陆上市, 因此我们期待未来在中国的临床研究和临床实践能给出正确的答案。(4)如何安全地进行治疗。虽然和化疗相比, 免疫治疗在诸多方面显示出安全性优势, 但免疫治疗相关的安全性事件在临床研究和临床实践中不断显现, 应引起我们的高度重视, 主要表现为多系统受累的不良反应, 如皮肤、胃肠道、肝脏、间质性肺炎、内分泌功能失调等[9]。其确切机制尚不清楚。因此目前仍无法预测哪些患者会出现免疫相关不良反应, 无法完全预防。目前建议在开始治疗前对患者进行风险评估。并对治疗过程中出现的不良反应及时给予干预和处理, 以最大限度地降低风险。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|