作者简介:马清光(1966-),男,黑龙江宾县人,主任医师,硕士研究生,从事循证检验医学研究。
目的 评价外周血γ-干扰素释放试验对结核性胸腔积液的诊断价值。方法 通过计算机检索PubMed、EMBASE、MEDLINE、Cochrane 图书馆外文文献和万方、维普和中国知网中文文献,全面收集外周血中γ-干扰素释放试验诊断结核性胸腔积液的相关研究,检索时限为建库至2016年7月1日。由两位评价者分别独立筛选文献、提取资料和进行方法学评价后,采用Meta-Disc 1.4软件进行Meta分析。结果 最终纳入40个研究,共计3 306例病例。γ-干扰素释放试验诊断结核性胸腔积液的合并敏感度为0.865,95%可信区间 0.848~0.880;合并特异度为0.782,95%可信区间0.760~0.803;合并诊断优势比为23.84, 95%可信区间16.66~34.13;汇总受试者工作曲线下面积为0.907 3。结论 外周血γ-干扰素释放试验对结核性胸腔积液具有较高诊断价值。
ObjectiveTo systematically review the diagnostic value of peripheral blood interferon gamma release assays(IGRAs) for tuberculous pleural effusion.Methods We searched PubMed, EMBASE, MEDLINE, Cochrane Library of Foreign Literature and VIP Chinese literature, a comprehensive collection of research-related test for diagnosis of tuberculous pleural effusion on peripheral blood IGRAs from inception to July, 2016.Two reviewers screened literature according to the inclusion and exclusi critera, extracted data, and assessed the quality of included studies. MetaDisc 1.4 were used to conduct the meta-analysis.Results 40 studies included in the final total of 3 306 patients. IGRAs diagnosis of tuberculous pleural effusion pooled sensitivity (SEN) to 0.865 (95%CI 0.848~0.880); pooled specificity (SPE) was 0.782 (95%CI 0.760~0.803); pooled diagnostic odds ratio (DOR) to 23.84 (95%CI 16.66~34.13); area under the summary receiver operating curve (SROC) (AUC) was 0.907 3.Conclusion Peripheral blood IGRAs has a higher diagnostic value of tuberculous pleural effusion.
结核性胸膜炎(tuberculous pleurisy, TBP)是由于结核菌感染至胸膜下而引起的一种迟发型过敏反应, 它是最常见的肺外结核之一。结核性胸腔积液与癌性、炎性胸腔积液鉴别诊断仍然是临床难题, TBP常规的诊断方法包括细菌培养、腺苷脱氨酶(adenosine deaminase, ADA)及一些其它的生化试验检查等, 但这些方法都没有达到令人满意的敏感度和特异度。临床镜检找抗酸杆菌阳性率低, 而胸膜活检有创且难以推广, γ -干扰素释放试验(interferon gamma release assays, IGRAs)作为一种特异的快速诊断结核分枝杆菌感染的免疫学方法已成为研究热点[1, 2]。IGRAs包括结核感染 T 细胞酶联免疫斑点试验(T-SPOT.TB)和QuantiFERON-TB gold in-tube test(QFT-GIT)两种方法, 对于结核病的辅助诊断价值虽得到国内外的一致认同, 但对TBP的诊断价值仍存在争议[3, 4], 尚缺乏这方面的循证医学证据。为此, 本研究采用Meta分析方法对目前已发表的中英文文献进行系统评价, 以期为IGRAs诊断TBP提供循证医学证据。
1.1.1 研究类型 IGRAs诊断TBP的诊断性试验。文种限中、英文。
1.1.2 研究对象 ①TBP患者, 接受IGRAs检测; ②研究能获得IGRAs诊断TBP的真阳性值(true positive, TP)、假阳性值(false positive, FP)、假阴性值(false negative, FN)、真阴性值(true negative, TN)等原始数据。
1.1.3 诊断方法 待评价试验采用IGRAs检测, 以病原学或组织病理学为诊断金标准。
1.1.4 结局指标 敏感度(sensitiveness, SEN)、特异度(specificity, SPE)、阳性似然比(positive likelihood ratio, PLR)、阴性似然比(negative likelihood ratio, NLR)、诊断比值比(diagnostic odds ratio, DOR)、受试者工作特征曲线(receiver operating characteristic curve, SROC)下面积(area under the curve , AUC)。
1.1.5 排除标准 ①文摘及会议论文; ②病例未经“ 金标准” 确诊; ③资料、数据不全或重复发表的文献。
计算机检索Cochrane图书馆、EMBASE、MEDLINE、CBM、CNKI、Wanfang和VIP数据库, 查找有关IGRAs对TBP诊断价值的研究, 检索时限均为从建库至2016年8月。中文检索词包括:结核性胸膜炎、结核性胸腔积液、γ -干扰素释放试验、诊断; 英文检索词包括:tuberculous pleurisy、pleural effusion、interferon gamma release assays。以PubMed为例, 其具体检索策略为:#1 Tuberculous Pleurisies, #2 interferon gamma release assay, #3 enzyme-linked immunosorbent spot, #1AND#2OR#3。
由两位研究者按纳入排除标准筛选文献, 并按设计好的资料表格提取资料, 最后交叉核对提取数据信息, 如遇分歧, 通过讨论协商解决。文献提取的内容包括:研究对象、研究地点、样本量、检测方法、四格表数据TP、FP、FN、TN等。
两位研究者采用Cochrane协作网提供的诊断性研究系统评价纳入研究质量评价工具QUADAS 14条[5], 对纳入研究进行评价。按“ 是” 、“ 否” 、 “ 不清楚” 3个判断标准进行评价计分。
采用Meta-Disc1.4软件完成, 计算纳入文献合并的SEN、SPE、DOR、PLR、NLR, 并进行SROC曲线拟合分析。采用Spearman相关分析检验有无阈值效应, 各研究结果间的异质性分析采用c2 检验。各研究间不存在统计学异质性(P> 0.10, I2< 50%)时, 采用固定效应模型进行Meta 分析; 反之则采用随机效应模型, 并分析导致异质性的可能原因。对纳入研究采用 SROC 曲线分析, 计算AUC, AUC值越大, 越接近1.0, 提示诊断真实性越好。
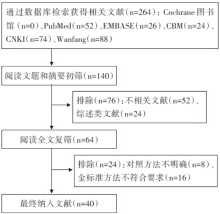
初检出文献264篇, 经逐层筛选后, 最终纳入40个研究[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45], 文献筛选流程及结果见图1。
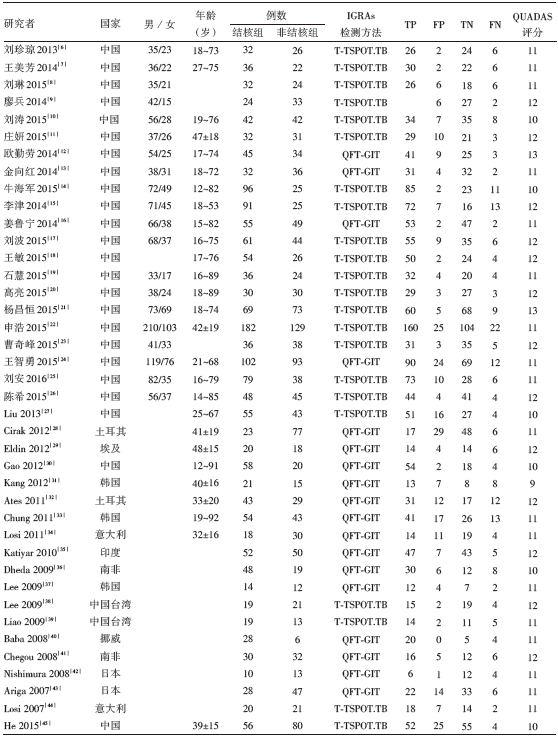
共纳入40篇文献, 中文文献21篇, 英文文献19篇; T-TSPOT.TB研究方法22篇, QFT-GIT研究方法18篇; 结核组患者1 830例, 非结核组患者1 476例; 纳入研究中的TBP病例均通过细菌学、病理学证据确诊结核性胸腔积液。纳入文献的QUADAS评分, 除1篇外均≥ 10分, 表明纳入研究质量较高。纳入研究的基本临床特征与QUADAS评分参见表1。
| 表1 纳入研究的基本特征 |
2.3.1 总体分析结果
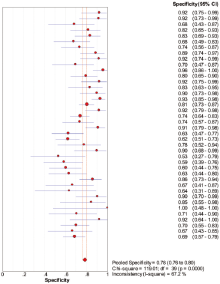
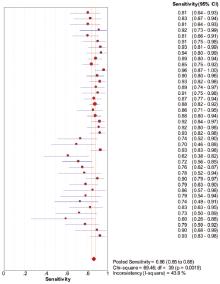
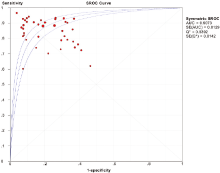
40个研究中, Meta-Disc 1.4软件输出的ROC平面散点图呈不典型“ 肩臂状” , Spearman相关系数=-0.278, P=0.082, 提示SEN与1-SPE呈负相关, 不存在阈值效应。对其他来源进行异质性检验, Meta分析结果见图2、图3、图4。
SEN:χ 2=69.46, P=0.002, I2=43.9%; SPE:χ 2=119.02, P=0.000, I2=67.2%。采用随机效应模型进行Meta分析, 结果显示:SEN=0.865, 95%可信区间0.848~0.880; SPE=0.782, 95%可信区间0.760~0.803; DOR=23.847, 95%可信区间16.661~ 34.132; AUC=0.907 3。本研究显示, Q值为0.839 2, SROC曲线下面积为0.907 3。提示IGRAs试验诊断结核性胸腔积液具有较高的价值。
2.3.2 异质性分析
采用研究的试验方法、发表时间、文献质量、国家来源4个指标做Meta回归分析, 根据P值大小按照逆方差权重法(inverse variance weights)依次排除发表时间、文献质量和试验方法的变量后, 最后得出国家来源的P值为0.000, 提示研究间异质性与纳入文献国家来源(P=0.00, DOR=0.18, 95%可信区间 0.11~0.31)、发表时间(P=0.003, DOR=0.31, 95%可信区间0.14~0.65)有关。
2.3.3 不同国家来源、试验方法亚组分析
24个研究来自中国, 16个研究来自其他国家。中国研究合并分析结果是:SEN=0.892, 95%可信区间0.874~0.908, I2=0.00%; SPE=0.816, 95%可信区间0.791~0.839, I2=65.5%; AUC=0.939 1。其他国家来源研究合并分析结果是:SEN=0.776, 95%可信区间0.734~0.815, I2=2.3%; SPE=0.710, 95%可信区间0.655~0.744, I2=50.2%; AUC=0.823 0。合并后敏感度的异质性明显降低, 特异度的异质性变化不大。
采用T-TSPOT.TB检测的研究22个, 采用QFT-GIT检测的研究18个研究。T-TSPOT.TB法合并分析结果是:SEN=0.881, 95%可信区间0.868~0.901, I2=0.00%; SPE=0.812, 95%可信区间0.791~0.842, I2=60.5%; DOR=34.33, 95%可信区间26.13~45.10; AUC=0.929 8。QFT-GIT法合并分析结果是:SEN=0.842, 95%可信区间0.810~0.860, I2=62.7%; SPE=0.742, 95%可信区间0.701~0.772, I2=68.2%; DOR=14.47, 95%可信区间7.85~26.66; AUC=0.866 9。合并后T-TSPOT.TB检测方法的异质性明显降低。
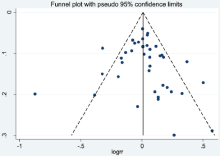
采用Stata软件做漏斗图对发表偏倚进行分析, 结果显示纳入研究在漏斗两侧分布的对称性较好, 见图5, 提示存在发表偏倚的可能性较小; 进一步的Egger检验显示未见发表偏倚(P=0.209)。
外周血IGRAs在结核性胸膜炎诊断应用中, 主要有T-TSPOT.TB和QFT-GIT两种方法。T-SPOT.TB的技术原理是结核杆菌感染者的全血及感染部位的体液中存在结核杆菌特异的效应T细胞, 这些细胞在受到结核杆菌特异抗原刺激后分泌γ -干扰素; 它应用的抗原 ESAT-6、CFP-10是结核分枝杆菌所特有的(其他分枝杆菌及卡介苗没有), 因此 T-SPOT 的敏感性和特异性高, 而且不受卡介苗接种和机体免疫状态的影响, 许多国家将其作为结核病的诊断检测方法[6, 7, 8, 9]。QFT-GIT 应用 ELISA 方法来检测受试者外周血淋巴细胞受结核分枝杆菌特异性抗原刺激后所释放的γ -干扰素, 其所使用的结核分枝杆菌抗原为 RD1 区的ESAT-6、CFP-10 和 RD11 区的 TB7.7 (Rv2654)。这些抗原均为结核分枝杆菌所特有, 可以避免与卡介苗接种之间的交叉反应。与目前广泛使用的 TST 比较, 具有更高的敏感性和特异性[12]。
本研究探讨外周血IGRAs对TBP的诊断价值, 包括T-TSPOT.TB研究方法22篇, QFT-GIT研究方法18篇。总体Meta分析结果显示, 外周血IGRAs具有较高特异度和敏感度, SROC曲线下面积为0.907 3, 提示对诊断TBP具有重要价值。本研究外周血IGRAs诊断TBP的敏感度是 86.5%, 特异度是 78.2%, 与文献报道敏感度 77.0%、特异度 71.0%[4]总体相符但还是有差异。
40个研究合并分析的异质性较高(I2=43.9%、I2=67.2%), 通过对纳入研究的“ 试验方法” 、“ 发表时间” 、“ 文献质量” 、“ 国家来源” 4个指标做Meta回归分析, 提示研究间异质性主要与纳入文献国家来源、发表时间有关, 与IGRAs试验方法、文献质量关系较小。经过亚组合并分析表明中国组、其他国家组的SEN的异质性很小(I2=0.00%、I2=2.3%), SPE的异质性仍然较高(I2=65.5%、I2=50.2%)。IGRAs试验方法的亚组分析, 同样是SEN的异质性明显减低, SPE的异质性仍然较高。SEN异质性低的原因可能与纳入研究采用统一金标准方法(病原学及组织病理学)诊断有关。我国是结核发病高风险地区, 与其他国家低风险地区检测阳性率也有差异[26]。由于纳入研究对照组病例地域差异、免疫状态、疾病背景不同都会影响到特异度差异, 导致SPE的异质性较高。
由于纳入的中国研究文献主要发表在2011-2016年间, 而其他国家文献主要集中在2007-2010年间, Meta回归分析发表时间和文献国家来源的意义相同。中国文献的研究方法主要是T-TSPOT.TB方法(17/22), 其他国家来源文献的研究方法主要是QFT-GIT研究方法(15/18), Meta分析结果表明T-TSPOT.TB方法SEN的异质性很小(I2=0.00%), QFT-GIT研究方法SEN、SPE的异质性均较高(I2=62.7%、I2=68.2%), T-TSPOT.TB方法优于QFT-GIT方法。差异原因可能与T-TSPOT.TB、QFT-GIT方法的差异有关。
本研究也存在一定局限性:(1)纳入研究存在较大异质性, 可能与不同国家结核发病率不同、纳入研究患者的基础疾病不同及IGRAs试验方法不同有关。(2)纳入的文献回顾性研究较多, 前瞻性研究较少, 未提及随机方法和盲法, 可能导致实施和测量偏倚。(3)纳入文献对研究组是以严格的金标准作为筛选, 而对照组病例的确诊却少有精确描述。
综上所述, 基于外周血IGRAs对诊断结核性胸膜炎具有重要辅助诊断价值。但由于受纳入研究质量和国家来源不同, 研究结果存在较大异质性。建议今后开展多中心、大样本医学研究, 得出更为可靠结论以指导结核性胸腔积液的鉴别诊断。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|