作者简介:马丽萍,主任医师/副教授,硕士研究生导师。中山大学孙逸仙纪念医院血液内科主任,大内科教学主任。长期工作在临床一线,对血液肿瘤的诊治有丰富的临床经验,在规范治疗的同时,善于总结并强调个体化治疗,擅长各种出凝血疾病的诊断。兼任广东省医学会血液学分会副主任委员,广东省医师协会血液学分会常委,广东省健康管理学会血液学分会副主任委员,中华医学会老年医学分会老年基础医学专业学组组员,全国高等医学教育学会临床医学教育研究会诊断学分会委员。《血栓与止血学》、《诊断学理论与实践》杂志编委。主持和主要参与国家自然科学基金、省自然科学基金等科研课题多项,参与本科规划教材《内科学》、《诊断学》的编写。
Prebet T, Sun Z, Ketterling RP, et al.Azacitidine with or without Entinostat for the treatment of therapy-related myeloid neoplasm: Further results of the E1905 North American Leukemia Intergroup Study[J]. Br J Haematol, 2016, 172(3):384-391.
1b。
• 治疗相关髓系肿瘤(therapy related myeloid neoplasm, t-MN), 定义为化疗或放疗后继发的骨髓增生异常综合征(myelodysplastic syndrome, MDS)或急性髓系白血病(acute myeloid leukaemia, AML), t-MN常显示基因易位如[KMT2A(MLL)、RUNX1、CBFB、RARA]或多个核型异常如5号或复杂染色体伴7号染色体缺失。t-MN对常规治疗反应差, 预后跟细胞遗传学、一般状况及前期癌症疾病和治疗有关。
• 阿扎胞苷(Azacitidine, AZA)为高危MDS的标准治疗方案, 对AML也有效, 回顾性研究显示AZA对t-MN总有效率为39%~43%, 中位生存期为10~14个月。
• Entinostat为口服组蛋白脱乙酰基酶(histone deacetylase, HDAC)抑制剂, Ⅰ 期临床研究认为AZA联合HDAC抑制剂在MDS和AML患者中的有效性及耐受性尚可。
比较AZA联合与不联合HDAC抑制剂在t-MN的疗效和不良反应。
• 研究条件:美国东部肿瘤协作组织及北美白血病组织开展的E1905临床研究。
• 研究方法:多中心、Ⅱ 期随机对照研究。
• 研究时间:2009年9月至2011年5月。
• 研究对象:入选患者需满足以下条件:①根据WHO2008标准, 诊断为治疗相关MDS(therapy related MDS, t-MDS)及治疗相关AML(therapy related AML, t-AML)。②t-MDS患者可为IPSS评分任何分类, 但低危或中危MDS患者, 血小板需< 50× 109/L, 中性粒细胞< 0.5× 109/L。③AML不限原始细胞数量, 但不应有疾病迅速进展迹象(白细胞> 30× 109/L或白细胞> 20× 109/L且倍增时间小于4周)。患者之前未使用过HDAC抑制剂, 未进行过化疗及造血干细胞移植。
• 干预措施:纳入47例t-MN患者; 中位年龄69岁(39~83岁); 45%为男性; 94% 患者ECOG (PS) 0~1; 29例为 t-MDS , 18例为 t-AML。AZA组(对照组, 24例)的治疗方法为AZA 50 mg/(m2∙ d), 皮下注射, d1~d10。AZA联合Entinostat 组(联合组, 23例)的治疗方法为AZA 50 mg/(m2∙ d), 皮下注射, d1~d10; Entinostat口服4 mg/(m2∙ d), d3、d10, 28天为1疗程。
• 评价指标:完全缓解率, 部分缓解率, 主要血液学改善率。
| 表1 血液学反应效果评估 |
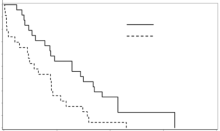
对照组血液学总有效率为46%, 缓解率(完全缓解和部分缓解)为 17%, 主要血液学改善率为29%; 联合组血液学总有效率为17%, 缓解率为0%, 主要血液学改善率为17%(46% vs. 17%, P=0.06)。 疗效情况见表1。中位随访21个月, 4例患者生存, 43例患者死亡, 中位总生存期对照组为13个月, 联合组为6个月, 总体患者的2年总生存率小于15%, 只有1例对照组患者造血干细胞移植后达到长期生存, 生存曲线见图1。
不良反应:3/4级非血液学毒性反应为57%(对照组为54%, 联合组为 61%) , 几乎所有患者均出现血液学毒性反应(对照组为100% , 联合组为87%)。 终止治疗常见原因为疾病进展(共13例, 对照组10例, 联合组3例)或治疗毒性反应(共13例, 对照组3例, 联合组10例), 共8例患者死亡(对照组1例, 联合组7例)。见表2。
| 表2 两组的不良反应情况 |
AZA联合HDAC抑制剂对t-MN的疗效不优于单用AZA, 而且会增加毒性反应。
t-MN是肿瘤或一些良性疾病经放/化疗后所致。随着医学技术的进步, 肿瘤患者的生存期有了较大的提高, 但同时放/化疗等治疗手段所引起的长期不良反应尤其是t-MN逐渐显现。由于总体病例数较少且患者既往放/化疗对造血干细胞的损伤、药物对脏器的累积毒性作用, 使t-MN可选择的治疗方案受到限制, 传统化疗的疗效不佳, 即使接受异基因造血干细胞移植, 这部分患者的预后仍不理想, 需要在遵循个体化治疗原则的基础上, 积极探索疗效确切且安全的治疗方案。
AZA作为DNA甲基转移酶抑制剂, 在年老、无法耐受常规化疗或移植前的桥接治疗或失去移植时机的MDS/AML患者中, 证明是一种低毒而有效的治疗方法。FDA推荐AZA治疗MDS的标准剂量是:75 mg/(m2∙ d), 7天, 28天为1个疗程, 至少4个疗程。长期用药可提高高危MDS患者的生存率。除了去甲基化药物, 另一种与表观遗传学信号通路密切相关的HDAC抑制剂在血液恶性肿瘤治疗的临床研究中也取得了较好的疗效。去甲基化药物和HDAC抑制剂可能有相互协同的效应。
E1905研究(NCT00313586)是美国东部肿瘤协作组织及北美白血病组织开展的多中心、随机对照、前瞻性Ⅱ 期临床试验, 目的是观察更低日剂量[50 mg/(m2∙ d)]及更长时间(10天)的AZA单药皮下注射(对照组)或联合HDAC抑制剂Entinostat[4 mg/(m2∙ d), 8天, 口服](联合组)对MDS及AML的有效性和安全性评估。共纳入196例MDS/AML患者, 其中149例为原发MDS/AML, 47例为t-MDS/t-AML。研究结果目前分两部分报道:①针对149例为原发MDS/AML的研究已发表[1], 结果显示不论是对照组还是联合组, 治疗后患者的血液学正常化率, 包括完全缓解、部分缓解及三系造血改善均得到提高, 两组间血液学正常化率、总反应率、总生存期及毒性反应等差异均没有统计学意义; HELP检测发现AZA与Entinostat在药效学上存在相互拮抗作用, 即Entinostat可削弱AZA的去甲基化作用。提示延长AZA的给药时间[50 mg/(m2∙ d), 10天]有助于提高MDS/AML的血液学反应率, 但AZA与Entinostat联合, 无论在疗效还是毒性方面, 均无协同作用。②本文报道的是针对47例t-MDS/t-AML(t-MDS 29例, 18例t-AML)的研究结果, 两组患者的年龄、性别、ECOG PS评分、疾病类型、骨髓原始细胞数、IPSS评分及血细胞输注依赖程度等均无差异。但两组在治疗反应上则出现明显差异, 即对照组的疗效好于联合组, 体现在联合组治疗不耐受或者死亡的比例明显增高, 血液学正常化率、总有效率及持续反应时间均低于对照组。与接受相同方案的原发MDS/AML(对照组和联合组)的总有效率和总生存率比较, 对照组间无明显差异, 但联合组中t-MN的总有效率及总生存率均明显低于原发MDS/AML。综合现有数据, 提示AZA单药治疗t-MN的短期疗效与原发MDS/AML相当, 可作为t-MN的治疗选择; 不推荐AZA+Entinostat的联合用药。
本研究是多中心、前瞻性的随机对照研究, 尽管由于t-MN本身发病率较低, 导致入组病例数较少, 但其方案设计合理, 结论仍比较可靠, 对临床医生选择t-MN的治疗策略时, 不要为了提高疗效而盲目追加药物具有重要的参考价值。然而, 同样是作用于表观遗传学通路, 为何AZA与Entinostat联用对于t-MN会有如此大的毒性, 与HDAC抑制剂的具体类型和剂量有没有关系, 文章没有进一步阐述。Entinostat作为第一个在乳腺癌中取得喜人试验结果的HDAC抑制剂, 在血液肿瘤方面疗效如何, 与其他药物联用时如何确定药物的体内药效机制以及量效关系, 都还有待更多的数据来明确。
另外, 作者也注意到, 对于t-MN, 即使采用AZA单药治疗, 长期预后仍然不理想。在新药频出的时代, 如何设计出与现行疗法相比更有效、更安全及更有望令t-MN患者受益的新方案, 是摆在研究者面前的难题。要解决这样的难题, 任重而道远。
The authors have declared that no competing interests exist.
| [1] |
|