作者简介:姚和瑞,教授,主任医师,博士研究生导师,中山大学孙逸仙纪念医院院长助理、乳腺肿瘤中心内科主任、乳腺肿瘤中心副主任、肿瘤科副主任。 广东省抗癌协会肿瘤转移专业委员会副主任委员(后任主任委员),广东省胸部肿瘤防治研究会乳腺癌专业委员会副主任委员,广东省中医药学会乳腺病专业委员会副主任委员,广东省保健协会乳腺保健分会副主任委员,广东省医学会肿瘤内科分会常务委员。
姚和瑞教授长期从事乳腺癌等恶性肿瘤的临床及基础研究工作。 承担国家自然科学基金5项(重点支持项目1项)。主编《乳腺癌内科治疗》, 副主编《小分子RNA的基础研究与临床应用》。 获得国家自然科学奖二等奖(第三完成人)、教育部自然科学奖一等奖(第二完成人)、广东省自然科学奖一等奖(第二完成人)。主办广东省肿瘤转移大会及广东省乳腺癌ASCO会后会。入选2015年、2016年、2017年岭南名医录。
Sikov WM, Berry DA, Perou CM, et al. Impact of the addition of Carboplatin and/or Bevacizumab to neoadjuvant once-per-week Paclitaxel followed by dose-dense Doxorubicin and Cyclophosphamide on pathologic complete response rates in stage Ⅱ to Ⅲ triple-negative breast cancer: CALGB 40603 (Alliance)[J]. J Clin Oncol, 2015, 33(1):13-21.
1b。
既往研究表明, 大约三分之一的Ⅱ /Ⅲ 期三阴性乳腺癌(triple-negative breast cancer, TNBC)患者经蒽环和紫杉类为基础的常规新辅助化疗后能达到病理完全缓解(pathologic complete response, pCR), 达到pCR将能改善患者的生存预后。目前, 在标准新辅助化疗中添加卡铂和/或贝伐单抗能否提高TNBC患者的pCR率和生存预后尚不明确。
探讨在标准新辅助化疗中增加卡铂和/或贝伐单抗对Ⅱ /Ⅲ 期TNBC患者的pCR率及安全性的影响。
• 研究条件:CALGB 40603研究。
• 研究时间:2009年5月至2012年8月。
• 研究方法:前瞻性、2× 2析因设计、开放性、Ⅱ 期随机对照临床试验。
• 研究对象:临床TNM分期为Ⅱ /Ⅲ 期的初治、可手术、经组织活检证实的非炎性浸润乳腺癌, 雌激素受体(estrogen receptor, ER)和孕激素受体(progesterone receptor, PR)表达≤ 10%且人类表皮生长因子受体2( human epithelial growth factor receptor 2, HER2)阴性, 无贝伐单抗使用禁忌证。
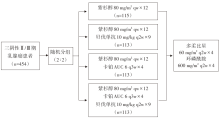
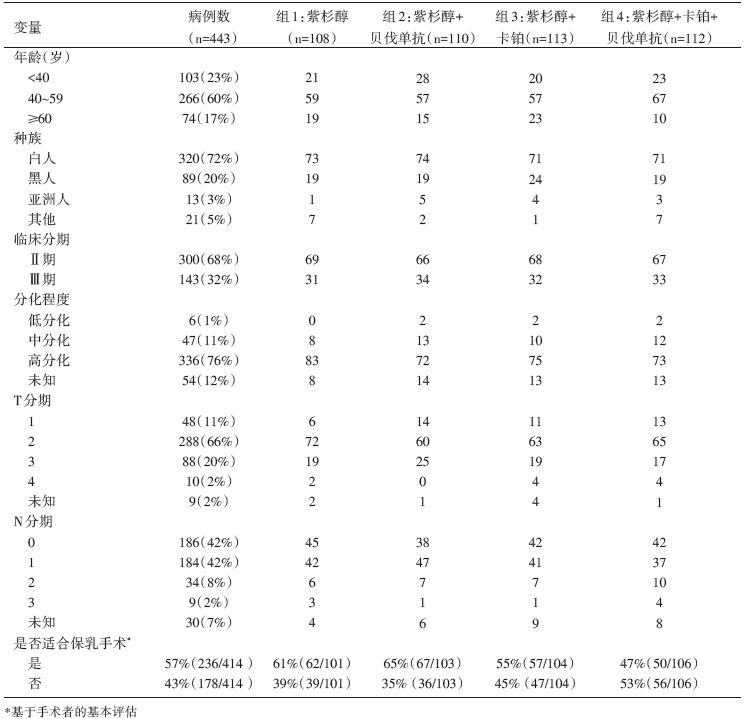
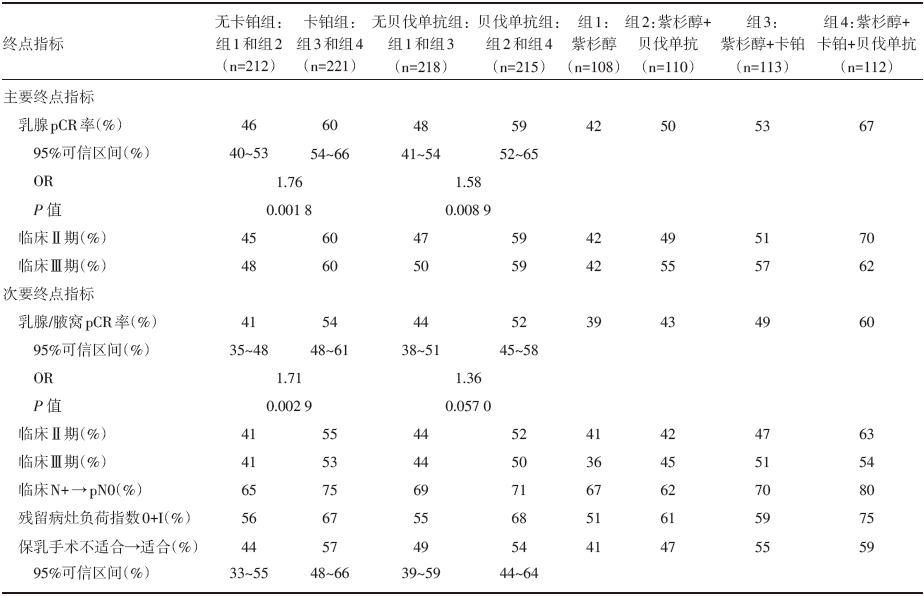
• 干预措施:总共入组454例患者, 接受紫杉醇周疗(80 mg/m2, 每周1次, 共12周), 序贯剂量密集AC方案化疗(多柔比星联合环磷酰胺, 每2周1次, 共4个周期), 在此化疗方案的基础上, 全组患者依据是否在单周紫杉醇化疗的同时加入卡铂(AUC=6, 每3周1次, 化疗4周期)和/或贝伐单抗(10 mg/kg, 每2周1次, 治疗9周期)随机分为四个治疗组:组1, 紫杉醇周疗+序贯剂量密集AC方案化疗; 组2, 紫杉醇周疗+序贯剂量密集AC方案化疗+贝伐单抗; 组3, 紫杉醇周疗+卡铂+序贯剂量密集AC方案化疗; 组4, 紫杉醇周疗+卡铂+序贯剂量密集AC方案化疗+贝伐单抗(见图1)。
• 评价指标:主要研究终点为乳腺病灶pCR率, 次要终点指标包括乳腺及腋窝pCR率、治疗方案实施、治疗相关毒性、残留肿瘤负荷指数, 临床阳性淋巴结化疗后呈病理阴性的转换率, 不能保乳病例化疗后可保乳的转换率。
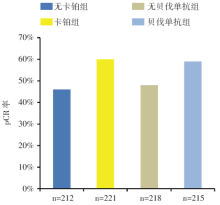
新辅助治疗方案中加卡铂组与不加卡铂组的乳腺pCR率分别为60%(95%可信区间为54%~66%)和46%(95%可信区间为40%~53%), 相比较的比值比为1.76, P=0.001 8(见图2)。含贝伐单抗组的乳腺pCR率为59%(95%可信区间为52%~65%), 不含有贝伐单抗组的乳腺pCR率为48%(95%可信区间为41%~54%), 两组pCR率比较的比值比1.58, P=0.008 9(见图2)。在含有卡铂及贝伐单抗方案组中乳腺pCR率达到67%, 但与其他组相比差异没有统计学意义(P=0.52)。
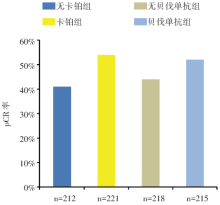
新辅助治疗方案中加入卡铂提高了乳腺肿瘤/腋窝转移淋巴结的pCR率。增加卡铂与不加卡铂治疗组相比, 患者的乳腺及腋窝pCR率从41%(95%可信区间为35%~48%)提高到54%(95%可信区间为48%~61%), 两组pCR比较的比值比为1.71, P=0.002 9(见图3)。加与不加贝伐单抗治疗组相比, 患者的乳腺及腋窝pCR率由44%(95%可信区间为38%~51%)提高至52%(95%可信区间为45%~58%), 但两组之间的比值比差异没有统计学意义(P=0.057, 见图3)。接受卡铂化疗和贝伐单抗治疗的患者获得的乳腺肿瘤/腋窝转移淋巴结pCR率最高(60%)。
其余次要研究终点指标如残留肿瘤负荷指数、临床阳性淋巴结化疗后呈病理阴性的转换率和非保乳病例化疗后可保乳的转换率, 其结果模式与前述主要研究指标大致类似(见表2)。
| 表2 各组治疗终点指标结果 |
卡铂化疗组患者较无卡铂化疗组更可能中止至少2程以上的单周紫杉醇化疗(36% vs 16%), 但只有同时接受卡铂和贝伐单抗治疗的患者(组4)才更容易中止多柔比星+环磷酰胺双周化疗。无论是添加卡铂和/或贝伐单抗, 试验组中需要减少化疗剂量的比率(紫杉醇或多柔比星+环磷酰胺化疗剂量降低)均高于对照组。由于治疗的延迟性及相关毒副作用的原因, 卡铂化疗组中, 只有80%患者完成了计划的4周期化疗; 而贝伐单抗组中, 只有66%的患者完成了至少8个周期的治疗。相比之下, 对照组(组1)患者更容易完成计划的新辅助化疗(87%), 仅仅只有1例患者因治疗的毒副反应和6例患者因肿瘤的进展而终止治疗。而在试验组中的患者更可能试验早期就终止治疗, 其具体原因包括治疗的毒副反应(其中单纯卡铂化疗组中有6例, 接受贝伐单抗治疗组中有26例)、患者拒绝后续治疗、肿瘤进展或其他原因。
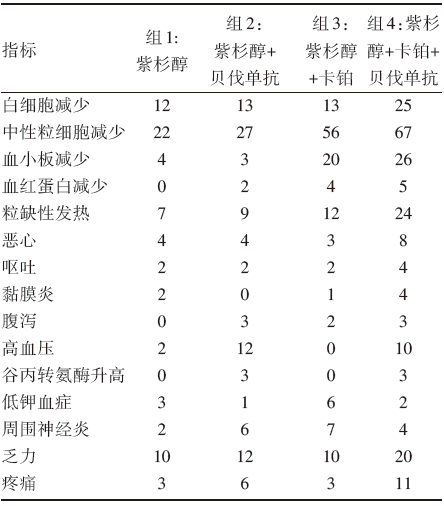
卡铂化疗组中, 3~4级中性粒细胞及血小板下降明显高于非卡铂化疗组。接受贝伐单抗的患者较未接受者更可能发生3级高血压(10%~12% vs. 0%~2%)。总体来说, 接受卡铂和/或贝伐单抗的患者, 其3级以上的毒副反应或需要住院及手术干预的副反应高于对照组, 尤其是接受贝伐单抗治疗的患者 (见表3)。
| 表3 3~4 级治疗相关毒副反应% |
新辅助化疗中增加卡铂或贝伐单抗能显著提高Ⅱ /Ⅲ 期TNBC的pCR率, 但这能否带来无复发生存及总生存期的获益尚不明确。未来仍需要更多更高级别的临床研究进一步评估卡铂的作用。
TNBC指ER、PR及HER2均为阴性的一类乳腺癌, 不能从内分泌及抗HER2靶向治疗中获益。由于缺乏有效的治疗手段, 通常预后差、易发生复发和转移。现阶段化疗是TNBC的标准治疗方案、具有重要的作用[1]。
TNBC采用紫杉类和蒽环类药物为基础新辅助化疗后, 大约1/3的患者可获得pCR。已有研究证实新辅助化疗后的pCR状态与患者的预后密切相关, 即pCR者较非pCR者可获得更好的无瘤生存及总生存[1, 2]。正因如此, 如何进一步提高TNBC新辅助化疗后pCR率成为了目前研究的热点之一。铂类化疗药物主要通过诱导双链DNA断裂而杀死癌细胞, 而贝伐单抗(Bevacizumab)是抑制肿瘤新生血管、拮抗人类血管内皮生长因子(vascular endothelial growth factor, VEGF)的重组单克隆抗体。既往的研究证实铂类及贝伐单抗在治疗转移性TNBC中获得了一定的临床疗效, 但在新辅助化疗中这两类药物的加入是否能够进一步提高pCR和预后尚不明确。
GeparQuinto和NSABP B-40临床随机对照试验研究了贝伐单抗在新辅助治疗中的作用[3, 4], 两项研究均显示在新辅助化疗中增加贝伐单抗能显著提高pCR率。然而GeparQuinto研究的亚组分析显示在663例TNBC中增加贝伐单抗能明显提高pCR率, 相反, NSABP B-40研究则显示在ER阳性的乳腺癌患者中能得到更明显获益(15.1% vs. 23.2%, P=0.007), 而ER阴性组尽管贝伐单抗组患者的pCR率高于无贝伐单抗组, 但差异却无统计学意义 (51.5% vs. 47.1%, P=0.34)。除贝伐单抗外, 一些临床试验尚研究了新辅助化疗添加铂类能否提高TNBC的pCR率, 在GeparSixto研究中[5], von Minckwitz等分析了卡铂在588例Ⅱ /Ⅲ 期HER2阳性及TNBC患者中的治疗效果, 结果表明在HER2阳性患者中增加卡铂没有明显提高乳腺pCR率(P=0.581), 然而在TNBC中增加卡铂能明显提高乳腺pCR率(P=0.005), 但增加卡铂也提高了血液及非血液毒副作用。但在GEIGAM研究中, 添加卡铂到新辅助化疗中并不能提高pCR率[6]。
针对上述已发表的临床研究, 本文分析的GALGB 40603临床试验采用巧妙的2× 2析因设计, 454例TNBC随机分为四组, 分别为:组1:紫杉醇; 组2:紫杉醇+贝伐单抗; 组3:紫杉醇+卡铂; 组4:紫杉醇+卡铂+贝伐单抗。该研究设计总体来说可回答以下几个问题:(1)新辅助化疗中添加卡铂能否提高pCR率?(2)新辅助化疗中添加贝伐单抗能否提高pCR率?(3)新辅助治疗中同时加入卡铂及贝伐单抗能否获得最高pCR率?(4)添加卡铂和/或贝伐单抗的相关毒副反应。可以说, 该临床试验进一步探讨了既往研究之间存在的争论与分歧。该研究结果表明无论添加卡铂(60% vs. 46%, P=0.001 8)或贝伐单抗(59% vs. 48%, P=0.008 9)均可提高乳腺肿瘤pCR率, 对于乳腺肿瘤和腋窝转移淋巴结, 仅卡铂(54% vs. 41%, P=0.002 9)提高pCR率, 添加贝伐单抗虽然提高乳腺和腋窝pCR率, 但差异无统计学意义(44% vs. 52%, P=0.057)。同时添加卡铂和贝伐单抗乳腺肿瘤pCR率达67%。但伴随卡铂和/或贝伐单抗添加的同时, 治疗相关的毒副反应也明显严重, 这其中包括3级以上的骨髓抑制和3级高血压的发生。新辅助化疗的完成率也较对照组明显降低。
新辅助化疗中添加铂类或贝伐单抗带来的pCR率的提高能否转化为生存获益尚有争论, GeparQuinto研究长期随访结果证明在新辅助化疗中添加贝伐单抗对比单纯化疗并未能明显延长无病生存期(P=0.784)和总生存期(P=0.842), 三阴性亚组的结果也类似[7]。NSABP B-40结果显示在乳腺癌新辅助化疗中增加贝伐单抗虽不能延长无病生存期(P=0.06), 但能明显延长总生存期(P=0.004)[8]。本文分析的CALGB 40603研究结果显示在Ⅱ /Ⅲ 期TNBC的新辅助化疗中添加卡铂或贝伐单抗能明显提高pCR率, 但文章发表时未报道pCR能否带来长期的生存获益。事实上该研究的后续生存随访结果初步报道于2015年12月的圣安东尼奥乳腺癌会议上, 结果显示添加卡铂或贝伐单抗与不加相比都不能明显改善患者的无病生存期和总生存期[9]。该次圣安东尼奥乳腺癌会议亦报道了GeparSixto研究的随访结果, 含卡铂的联合方案对TNBC患者改善了无病生存期。以上研究表明, 增加贝伐单抗在乳腺癌新辅助治疗中虽然部分患者达到了pCR, 但能否完全转化为无病生存期和总生存期获益存在争议。
随着铂类药物或贝伐单抗的添加, 治疗相关毒副反应是明确增加或加重的, 这其中包括3级以上的骨髓抑制和3级高血压的发生。新辅助化疗的完成率也较对照组明显降低, 而这是否会影响对潜在转移病灶的控制从而影响生存?这有待更多的长期随访数据来回答。其次, 尽管pCR预测临床远期获益已经被不同研究所证实, 但这种关联性还仅仅停留在个体水平, 即获得pCR 的患者。而基于研究水平, 不同治疗组获得pCR率的高低尚不能作为无瘤生存或总生存的替代终点指标, 也即并非pCR率越高就对应于整个治疗群体的远期生存越高[6]。pCR能否替代总生存或无瘤生存作为终点指标尚有待更充分的循证医学证据。
综上所述, 在TNBC新辅助治疗中添加卡铂与贝伐单抗可提高pCR已在多项临床试验中得到了证实, 但尚不明确这能否转化为长期的无病生存期和总生存期获益, 因此未来需要更多更高级的循证医学证据去探索卡铂与贝伐单抗在早期TNBC新辅助治疗中的治疗地位。对于GALGB 40603临床试验更长期的随访结果, 我们将拭目以待, 同时在未来TNBC的研究中, 选择更同质化的人群, 采用更优的临床设计, 可能会更好地明确铂类与贝伐单抗在新辅助化疗中的地位以及新辅助化疗后pCR与远期生存之间的内在关联性, 从而指导个体化的治疗。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|