作者简介:王先明教授,深圳大学第一附属医院(深圳市第二人民医院)乳房疾病诊疗中心主任、外科学教授、博士研究生导师。美国乳腺外科医师协会会员,亚洲乳癌协作组常务委员,中国医师协会外科分会乳腺专业委员会委员,广东省医学会乳腺病学会副主任委员,广东省抗癌协会乳腺癌专业委员会常务委员,广东省医师协会乳腺疾病工作指导委员会副主任委员,深圳市抗癌协会副理事长,深圳市抗癌协会乳腺癌专业委员会主任委员,深圳市医师协会乳腺专科医师分会理事长;《中国现代手术学杂志》常务编委,《中国普通外科杂志》、《中华乳腺病学杂志》、《中华内分泌外科学杂志》编委。
从事乳房外科临床与科研工作近30年,擅长乳腺癌的早期筛查诊断,各类手术治疗包括改良根治术、保乳术、再造术等,基因分子水平诊疗,中晚期肿瘤多学科治疗与健康管理。精通乳管镜、微创活检及液体活检,并致力于原位癌、乳腺炎、纤维腺瘤等癌前病变与良性疾病的诊治。率先在国内提出和倡导“人性化(生物—心理—社会—文化)医学模式”在乳房临床中的应用。紧跟乳腺癌国际研究趋势,以乳腺癌分子生物学分型为基础指导乳腺癌的临床靶向治疗,取得了良好的社会效益。
Nanda R, Chow LQ, Dees EC, et al.
Pembrolizumab in patients with advanced triple-negative breast cancer: Phase Ⅰ b KEYNOTE-012 study[J]. J Clin Oncol, 2016, 34(21): 2460-2467.
2a。
三阴性乳腺癌(triple negative breast cancer, TNBC)即激素受体 (hormone receptor, HR)阴性、人表皮生长因子受体2(human epidermal receptor 2, HER 2)阴性的亚型, 占乳腺癌总发病率的20%。该亚型相较于激素受体阳性的乳腺癌亚型, 通常具有更高的病理分级, 易进展且侵袭性强, 因为缺少治疗靶点导致治疗策略单一, 只能选择毒副作用大的全身性化疗。
目前研究表明程序性死亡受体1(programmed death receptor 1, PD-1)单克隆抗体Pembrolizumab通过阻断PD-1/PD-L1信号通路, 激发人体自身免疫系统对抗肿瘤细胞及避免肿瘤逃逸, 对TNBC、黑色素瘤、胃癌、泌尿道上皮细胞癌及头颈部癌症等多种晚期进展性PD-L1阳性恶性肿瘤具有治疗潜力。
评估单克隆抗体Pembrolizumab治疗PD-L1阳性进展期TNBC的安全性及疗效。
• 研究条件:KEYNOTE-012 (NCT01848834)研究。
• 研究方法:国际多中心、非盲、多队列、Ⅰ b期临床试验。
• 研究时间:截至2015年3月23日, 中位随访时间10个月(0.4~19.5个月)。
• 研究对象:年龄≥ 18岁; HR和HER2阴性的复发或转移性乳腺癌, 可用实体瘤缓解评价标准(RECIST v1.1)评估, ECOG≤ 1分, 任何前期系统性治疗, PD-L1阳性。排除标准包括:入组前7天内使用全身性激素治疗, 第一次Pembrolizumab用药在化疗后2周内; 进展期脑转移(已治疗或稳定脑转移可入组), 前期治疗中已使用PD-1/ PD-L1/CLTA-4单抗, 活跃的免疫系统疾病患者。
• 干预措施:符合入组条件的患者接受Pembrolizumab单药治疗(每2周注射一次, 剂量10 mg/kg), 直到出现严重的毒副作用、疾病进展或研究终止。若临床情况稳定, 第一次影像学评估符合实体瘤缓解评价标准(RECIST v1.1)疾病进展的患者可继续接受Pembrolizumab治疗直到≥ 4周后第二次检查确定恶化。
• 评价指标:安全性终点指标是定期影像学及化验检查、生命体征及临床查体。首要疗效终点指标是总缓解率(overall response rate, ORR), 定义为患者达到完全缓解(complete response, CR)或部分缓解(partial response, PR)的最佳总缓解率。次要疗效终点指标是无进展生存期(progression-free survival, PFS)。
安全性:数据截止时中位治疗时间为59.5天(1~530天), Pembrolizumab中位治疗次数为5次(1~36次)。56.3%的患者发生至少一次不良事件, 其中15.6%发生至少3~5次不良事件。常见不良事件包括关节痛(18.8%)、疲劳(18.8%)、恶心(15.6%)。5个3级不良事件包括贫血、无菌性脑膜炎、粒细胞减少症、头痛及发热。1例患者死于弥散性血管内凝血(disseminated intravascular coagulation, DIC)。可能与免疫介导相关的不良事件包括1例结肠炎、1例肝炎、1例甲状腺功能减退症。1例患者在腹泻136天后出现小肠结肠炎。治疗相关毒副作用见表1。
| 表1 KEYNOTE-012 研究的毒副反应 |
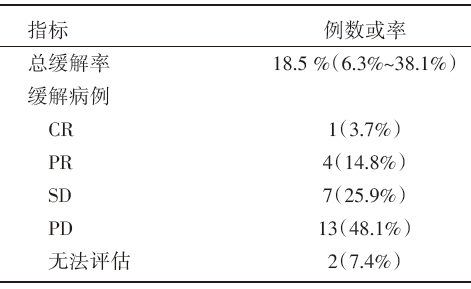
疗效:入组32名患者中27名符合标准, 采用实体瘤缓解评价标准(RECIST v1.1)评价。ORR为18.5% [95%可信区间(confidence interval, CI)6.3%~38.1%], CR率为3.7%, PR率为14.8%, 疾病稳定(stable disease, SD)率25.9%, 疾病进展(progressive disease, PD)率为48.1%, 疾病控制率为25.9% (95%CI 11.1%~46.3%)。疾病稳定的中位随访时间为17周(范围7.1~32.1周), 2例患者缓解时间≥ 24周。
22例患者的PFS分析显示, 中位PFS为1.9个月(95%CI 1.7~5.5个月), 在6个月时无进展生存率为24.4%, 中位缓解持续时间尚未达到。中位生存期为11.2个月(95%CI 5.3个月至今), 6个月和12个月的总生存率分别为66.7%和43.1%。
统计显示, 入组患者中37.5%实现了肿瘤负荷减轻, 并随时间推移持续减少。具体缓解率见表2。
| 表2 患者的治疗缓解情况 |
KEYNOTE-012研究初步证实, PD-1单克隆抗体Pembrolizumab在治疗进展期PD-L1阳性的TNBC中, 毒副反应具有一定耐受性, 能显著降低入组患者的肿瘤负荷, 总缓解率为18.5%。
PD-1是一种重要的免疫抑制分子, 在免疫应答调节中起着关键作用, 在活化的T细胞、B细胞、自然杀伤细胞、单核细胞, 树突状细胞、髓样细胞、胸腺细胞等免疫细胞及部分肿瘤细胞表面均有表达。PD-L1是PD-1的配体, 在黑色素瘤、非小细胞肺癌、胃肠道癌、泌尿上皮细胞癌、乳腺癌等多种癌细胞中高表达[1]。PD-1免疫治疗的机制是针对PD-1/ PD-L1受体设计单克隆抗体, 阻止PD-1/PD-L1的识别过程, 部分恢复T细胞功能, 从而使T细胞能够发挥对抗肿瘤细胞的免疫作用, 避免肿瘤细胞逃逸[2]。
GBI Research数据分析预计, 到2022年全球免疫治疗市场将达到742亿美元规模, PD-1/ PD-L1单抗是当前备受瞩目的新一类肿瘤免疫治疗药物, 具有重要的医疗价值和广阔的商业前景, 目前已有百时美施贵宝、默沙东、罗氏、默克/辉瑞、阿斯利康5个公司的产品上市。2015年, 罹患晚期黑色素瘤的美国第39届总统吉米· 卡特在接受Pembrolizumab(即PD-1单抗药物Keytruda® )4个月治疗后, 影像学检查发现脑部肿瘤病灶明显消失。这一案例为PD-1单抗免疫疗法起到了轰动性的宣传效果。各大制药巨头纷纷开展PD-1单抗治疗淋巴瘤、黑色素瘤、非小细胞肺癌、胃肠道癌、泌尿上皮细胞癌、乳腺癌等的临床研究, 并取得一定成绩。
TNBC作为一种侵袭性强、易转移、预后极差的乳腺癌分子亚型, 内分泌治疗和曲妥珠单抗靶向治疗无效, 依靠化疗为主, 如果只是常规的标准治疗, 其愈后依然很差, 无复发生存率和总生存率均相对较低[3]。但TNBC通常有较高的PD-L1表达水平和较高的肿瘤侵润淋巴细胞水平[4, 5, 6, 7, 8], 随着肿瘤免疫治疗的研究深入及在临床应用上不断拓展, 免疫检查点抑制剂或能发挥一定治疗效果, 为TNBC患者带来曙光。
非盲多队列Ⅰ b期临床试验KEYNOTE-012便是针对PD-1/PD-L1单抗的负性调节作用, 开展对PD-1免疫抑制剂Pembrolizumab(Keytruda)治疗各类型晚期进展期恶性肿瘤的研究。圣安东尼奥乳腺癌研讨会公布了KEYNOTE-012中Pembrolizumab单抗治疗进展期PD-L1阳性TNBC的早期数据, 显示18.5%的ORR, 为研发乳腺癌免疫治疗的靶点提供了支持数据[9]。
KEYNOTE-012研究中对Pembrolizumab单抗治疗进展期PD-L1阳性TNBC的安全性及疗效进行评估。所有入组患者均接受辅助或新辅助化疗后处于疾病进展期。研究表明Pembrolizumab治疗相关的3~5级不良事件发生率为15.6%, 与该药在其他进展期恶性肿瘤的治疗应用相比, 安全性与耐受性在可接受范围内。值得一提的是其ORR达18.5%, 包括1例CR。这是免疫调控抑制剂在治疗接受多次化疗后的进展期TNBC中取得临床疗效的首例报道。
Pembrolizumab单抗治疗多次化疗后进展期PD-L1阳性TNBC的随访时间(中位时间未到; 平均15.0~> 47.3周)中包括3例仍在跟踪随访中接受治疗≥ 1年, 待接受4~12周标准辅助化疗的患者。疾病控制率25.9%, 6个月无进展生存率24.4%, 6个月总生存率 66.7%。数据表明进展期PD-L1阳性TNBC经Pembrolizumab单抗治疗显著获益。
入组患者均接受过紫杉类药物治疗, 大部分接受过蒽环、铂类及卡培他滨治疗。4/5的患者有内脏转移, 表明免疫调控抑制剂对于接受多次化疗仍复发转移的恶性肿瘤仍有显著疗效。但研究指标中基础血清乳酸脱氢酶高于正常值2倍以上的患者无明显药物反应。我们不得不思考对于这类患者, 或许将免疫调控抑制剂与细胞毒性药物结合起来, 才能在免疫调控点起阻滞作用前控制住肿瘤的快速进展[10]。
该研究存在的缺陷。首先, 理论上Pembrolizumab治疗的临床获益程度与PD-L1的表达强度呈正相关性, 但目前取材组织量少, 且入组患者均为PD-L1阳性, 尚不能作为有力证据。使用PD-L1作为生物标志物尚存在争议[11]。未来的研究将进一步选取合适的生物标志物来筛选最能从免疫治疗中获益的患者。其次, 研究的样本量过小, 不利于Pembrolizumab的药物疗效验证及推广。并且入组前的过多化疗及血清乳酸脱氢酶水平高可能导致统计结果中药物有效率降低。这类患者的肿瘤具有较高的侵袭性和增殖能力, 入组后60天内均发生疾病进展。尽管如此, 在KEYNOTE-012研究中Pembrolizumab单抗治疗进展期TNBC的ORR(18.5%)仍比已报道的临床Ⅲ 期药物试验中卡培他滨的ORR(9%)高 [12]。
综上所述, KEYNOTE-012研究初步证实Pembrolizumab单抗治疗多次化疗后进展期PD-L1阳性TNBC显示出有效性, Pembrolizumab的安全性和疗效的Ⅱ 期临床试验正在开展中。这是继肿瘤疫苗研发、细胞因子疗法、单克隆抗体等生物免疫治疗后的又一重大发现。Pembrolizumab联合化疗、肿瘤疫苗等临床研究对进展期PD-L1阳性TNBC的治疗也有重大意义, 将为此类患者提供更多选择。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|