作者简介: 何国东(1988-),男,广州人,本科学士,从事Ⅰ期临床试验工作。
目的 评价健康人体对多次给药苯乙基异硫氰酸酯胶囊的耐受性与安全性。方法 采用单中心、双盲、随机、安慰剂对照试验。12名健康受试者参与为期28天的连续给药耐受性试验,给药组与安慰剂组各6人。口服苯乙基异硫氰酸酯胶囊30 mg/次,每天3次,连续给药28天。观察用药期间受试者临床症状、生命体征,血常规、尿常规、血生化、心电图、膀胱B超等的变化,并记录受试者每日出入量,观察和记录不良事件。结果 12名健康男性受试者接受耐受性及膀胱毒性观察,用药期间无脱落。本试验未发现药物对男性健康受试者的膀胱有明显影响。不良反应共12件,试验用药组7件,安慰剂组5件,给药组中3人诉口干。结论 药物的主要不良反应是口干,考虑环境、连续用药以及受试者本身生理变化等各种因素,认为30 mg/次、每天3次用药是基本安全的。
Objective To evaluate the safety, tolerance and make sure the safe dose range of single dose and continuous Phenethyl Isothiocyanate capsules in Chinese healthy volunteers.Methods A single-center, double-blind, randomized, placebo-controlled trial was used. 12 healthy subjects were enrolled in a 28 days continuous drug-tolerance trial, with 6 subjects in the study and 6 in the placebo group. Oral Phenylethyl Isothiocyanate capsules, 30 mg/time, three times a day, continuous administration of 28 days. The clinical symptoms, vital signs, blood routine, urine routine, blood biochemistry, electrocardiogram and bladder ultrasonography were observed during the course of administration. The daily intake and withdrawal of the subjects were recorded and adverse events were observed and recorded. Results This study did not find drugs on male healthy subjects have a significant impact on the bladder. There were 12 adverse reactions, test drug group were 7, placebo group were 5. 3 subjects of the test drug group complained of dry mouth, while not in the placebo group.Conclusion The main adverse drug reaction is dry mouth. Taking into account the environment, continuous medication and the subjects themselves physiological changes and other factors, that 30 mg/time, TID is basically safe.
苯乙基异硫氰酸酯胶囊的主要成份为β -苯乙基异硫氰酸酯(Phenethyl Isothiocyanate, PEITC)[1]。谷胱甘肽S-转移酶P1(glutathione S-transferase P1, GSTP1 )基因是重要的清除体内、细胞内有害物质的基因, 正常行使其功能有利于保护肌体、细胞不受有害物质的侵袭[2, 3]。文献资料证实在前列腺肿大及前列腺癌变过程中, GSTP1基因启动子异常甲基化而失活[4, 5, 6]。试验结果表明, 苯乙基异硫氰酸酯及其体内代谢物苯乙基异硫氰酸酯-N-乙酰半胱氨酸加合物能抑制GSTP1基因异常甲基化, 进而重新激活该基因的表达(中国发明专利200510040865.1; PCT国际专利WO 2007/056941), 可能是其治疗和预防前列腺增生、前列腺炎的重要机理之一。此外, 有学者对苯乙基异硫氰酸酯通过抑制雄激素受体(androgen receptor, AR)作用的机理做了进一步研究, 发现其通过抑制Forkhead Box O3a(FOXO3a)的活性, 进而抑制AR的表达[7, 8]。本研究旨在评价健康人体对多次给药苯乙基异硫氰酸酯胶囊的耐受性和安全性, 为进一步临床试验和应用提供依据。
年龄在 18~45岁的中国男性健康志愿者, 同一批受试者年龄不得相差 10岁以上; 体质量:男性受试者不低于50 kg, 体质量指数(body mass index, BMI)在19~24范围内; 全面健康体检合格; 实验室检查血常规, 尿便常规, 肝功能, 肾功能, 输血四项, 凝血四项, 腹部与膀胱B超, 心电图等检查未发现具有临床意义的异常。筛选前在被告知所有与药物有关的可能的不良反应后, 自愿参加本试验, 并签署知情同意书。
苯乙基异硫氰酸酯胶囊规格为10 mg, 口服给药, 密封、遮光、阴凉保存。
1.3.1 随机化方案
试验采用单中心按入选顺序号随机的方法。随机分配编码, 采用DAS软件在计算机上模拟产生并配备相应的药盒, 按受试者入组先后顺序, 选用序号相同的药盒进行给药和观察。
1.3.2 盲法
本试验为双盲法, 安慰剂和试验用药外观一致。研究者和受试者均不知道服用的是安慰剂或试验药。
1.3.3 分组与给药
给药组与安慰剂组各6人, 口服苯乙基异硫氰酸酯胶囊或安慰剂。30 mg/次, 每天3次口服, 连续给药28天。在每天07:00、15:00、23:00给予药物, 温水250 mL送服, 给药后检查受试者的手及口腔。
1.4.1 一般指标
包括人口学特征和相关病史。
1.4.2 安全性指标
(1)体格检查; (2)一般检查(生命体征); (3)实验室检查:血常规、尿常规、大便常规及隐血、凝血功能、血生化、12-导联心电图、Coombs溶血试验、抗IgG、乙肝表面抗原、丙肝病毒抗体、艾滋病病毒抗体、梅毒螺旋体抗体、胸透、腹部B超、泌尿科B超等检查。
1.4.3 不良事件
重点观测的不良事件包括一般中枢神经系统症状(头痛、头晕), 泌尿系统症状(尿频、尿急、血尿、尿不适), 消化道症状(恶心、呕吐、腹泻、腹痛)和口干等症状。对受试者的症状详细描述并定量记录, 如症状开始时间、程度、表现、合并治疗以及好转时间, 对于可能的泌尿系统症状如尿频, 记录每次排尿时间、排尿量、每日饮水量等。用药前提前一周入住Ⅰ 期临床试验病房, 使受试者熟悉环境, 并每日记录饮水量与排尿量作为基线值。用药期间, 每日记录受试者饮水量及排尿量。
计量资料采用均数± 标准差进行统计描述; 采用SPSS17.0统计分析软件; 与入选基础值进行比较, 采用配对t检验比较前后差异; 与安慰剂组比较, 采用独立样本t检验比较两组间的差异; 多组之间采用ANOVA分析。P≤ 0.05将被认为所检验的差别有统计学意义。
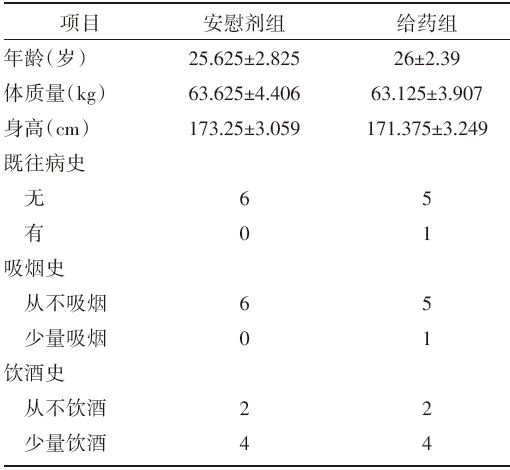
12名健康男性受试者, 试验给药与安慰剂组各6人, 用药期间无脱落。12名受试者均未婚、汉族人、无过敏史、无特殊家族史、体检正常, 其他信息见表1, 分析认为, 婚姻状况、年龄(岁)、体质量(kg)、身高(cm)等项目的组间比较, 差异无统计学意义, 具有可比性。
| 表1 受试者的人口学特征和相关病史 |
给药期间饮水量、饮水次数、排尿量、排尿次数各时点分析表明, 基线期、用药期间以及随访期间的组间比较, 差异无统计学意义(P> 0.05)。
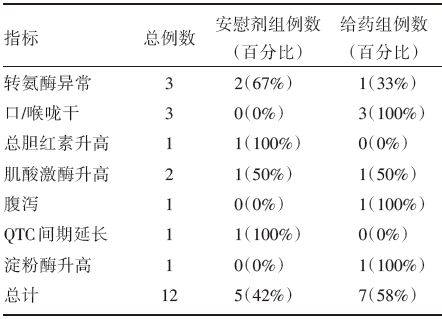
本研究中受试者在试验期间未见体温、心率、呼吸、血压等出现异常波动, 生命体征在给药前后变化差异无统计学意义。表2为不良事件发生情况, 所有不良事件均为轻度, 均随访至恢复正常或异常但无临床意义。
| 表2 不良反应发生情况 |
美国Kaphlan Comprehensive癌症研究中心联合纽约大学医学中心、美国健康基金会、明尼苏达大学完成了Ⅰ 期临床研究, Ⅰ A期单次耐受性剂量为5~40 mg单次每日剂量, 40 mg为最大耐受剂量, 在此基础上又进行了Ⅰ B期临床试验, 分别为每次10 mg、20 mg、30 mg、40 mg, 每日4次, 40~160 mg/日, 连续给药30天的耐受性和药代动力学研究, 结果显示主要不良反应包括胃部不适、腹泻、转氨酶升高, 未见任何与膀胱毒性相关的不良反应, 最终确定最大耐受剂量为120 mg/日。经FDA批准, 美国明尼苏达大学癌症中心开展了一项关于PEITC对健康吸烟人群肺癌预防作用的Ⅱ A期临床研究, 结果显示PEITC能降低烟草代谢后的致癌物活性, 为进一步研究PEITC预防肺癌的发生提供依据[9]。
本次研究中出现的转氨酶升高、口干、腹泻等不良反应与国外研究相仿, 其中2名受试者肌酸激酶升高, 给药组1人淀粉酶轻度升高, 无其他的不适, 血压在正常值范围内, 心电图检查也无异常, 由于出组时为长假期间, 故随访未能及时完成, 研究医生考虑该事件应为偶发事件。
试验给药组6人中有3人诉口干, 安慰剂组则无发生。出现此不良反应有可能与PEITC的化学性质有一定关系。辣根的辛辣刺激风味来源于其挥发油中的主要成份异硫氰酸酯[10]。研究人员采用气相色谱-质谱联用技术研究了辣根挥发油中的化学成分, 发现我国辣根的主要辛辣成分是β -苯基乙基异硫氰酸酯、烯丙基异硫氰酸酯、4-戊烯基异硫氰酸酯和5 -己烯基异硫氰酸酯 [11]。由于PEITC具有一定刺激性气味, 受试者服用PEITC胶囊后, 随着胶囊在消化道中溶解, PEITC对消化道黏膜产生一定刺激, 受试者就有可能出现口干感。
本次研究中所有不良反应均为轻度, 均随访至恢复正常或异常无临床意义。不良反应的发生与用药时间没有明显的关联, 故考虑不一定是由于连续用药蓄积导致。本试验不良反应发生率安慰剂组与试验用药组相当, 从结果看, 药物的主要不良反应是口/喉咙干, 故考虑环境, 连续用药以及受试者本身生理变化等各种因素, 认为30 mg/次, 每天3次用药是基本安全的。但由于本次试验受试者例数较少, 在后期的临床试验中, 应该继续关注研究药物的安全性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|