胡洁, 医学博士, 副主任医师, 复旦大学附属中山医院呼吸科、胸部肿瘤和呼吸介入亚专科副主任。专业方向为肺癌筛查、晚期肺癌个体化综合治疗、呼吸内镜技术。现为美国胸科医师学院FCCP, 中国医师协会呼吸医师分会肺癌专业委员会委员兼秘书, 中国临床肿瘤学会CSCO青年专家委员会委员, 中国医疗保健国际交流促进会胸部肿瘤分会委员, 上海市抗癌协会肿瘤呼吸内镜专业委员会常委, 上海市医学会呼吸专业委员会肺癌学组委员, 上海市抗癌协会肺癌分子靶向与免疫治疗专业委员会委员, 上海市医学会肿瘤学分会胸部肿瘤学组委员。《国际呼吸杂志》等杂志通讯编委。主持国家和上海市自然科学基金课题, 发表论文20余篇(SCI论文9篇), 参与编写《实用内科学》、《现代呼吸病学》等专著。
Bernhardt D, Bozorgmehr F, Adeberg S, et al. Outcome in patients with small cell lung cancer re-irradiated for brain metastases after prior prophylactic cranial irradiation[J]. Lung Cancer, 2016, 101:76-81.
2b。
• 约10%的小细胞肺癌(small cell lung cancer, SCLC)诊断时发现脑转移, 50%的患者在治疗2年内出现脑转移。
• 预防性脑放疗(prophylactic cranial irradiation, PCI)是局限期SCLC治疗完全缓解后的标准方案。
• PCI后脑转移并不少见, 并且预后差。对于PS状态好的患者, 再放疗被认为是一种治疗颅内进展的方案。
探讨接受过PCI的SCLC脑转移患者再次脑放疗的获益和毒副反应。
• 研究条件:德国海德堡大学医院的病例资料。
• 研究方法:回顾性病例分析。
• 研究时间:2008-2015年的病例资料。
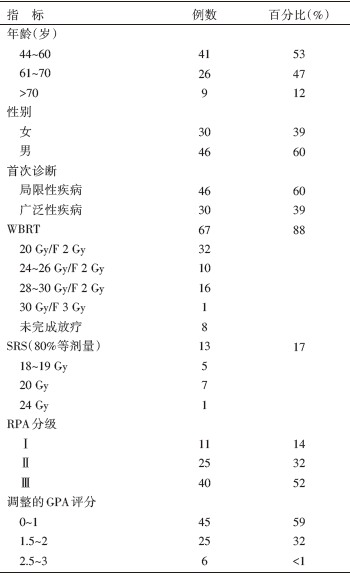
• 研究对象:420例既往接受过PCI治疗(30 Gy/15 F)的脑转移患者, 76例(18%)接受再放疗[全脑放疗(whole brain radiation therapy, WBRT)或立体定向放疗(stereotactic radiosurgery, SRS)]。
根据临床记录登记以下数据:年龄、分期、颅外疾病状态、首次诊断和脑转移数目、放疗的剂量、放疗前后的症状、对再放疗的反应、额外的治疗以及放疗的毒副反应、KPS评分。所有病例基于KPS评分、局部控制、年龄及颅外状态进行回归分配分级(recursive partitioning analysis, RPA), 并基于KPS评分、年龄、颅外症状(进展、稳定、完全缓解)以及脑转移数目设定调整分级预测指标评分(graded prognostic assessment, GPA), 见表1。
| 表1 76 例接受脑再放疗的脑转移患者的病例特征 |
对再放疗前患者的神经功能状态进行分级:无症状(0), 轻微的神经症状(1), 中度神经症状(2), 严重并且需要住院的症状(3), 需要住院并特别护理的症状(4)。基于PS评分、疾病的状态、脑转移的数目决定行再次WBRT或者SRS, SRS限用于不超过4个脑转移灶病例。既往所有接受的全脑放疗剂量为30 Gy/15 F, 除外1例其它中心病例接受过30.6 Gy/17 F。
• 评价指标:总生存期(overall survival, OS)和毒性(toxicity)。
• 生存情况:总共76例患者, 随访中73例死亡, 1例失访, 2例仍在存活中。中位OS为3个月(0~12月), 再次WBRT组的中位OS为3个月(0~12个月), 再次SRS组的中位OS为5个月(0~12个月)。两组比较的生存分析(Kaplan-Meier’ s)结果为:风险比1.69, 95%可信区间0.90~3.14; P=0.097。
评估了再放疗前患者的神经系统功能状态, 32例无症状[神经功能缺损评分(neurological function scale, NFS)0], 25例轻微至中等症状(NFS 1~2), 19例严重症状(NFS 3~4)。NFS 0组无进展生存期(progression-free survival, PFS)为4个月, 其余组为3个月, 组间差异无统计学意义。对于RPA分级, 再次WBRT组在Ⅰ 级病例的中位OS为2.5个月, Ⅱ 级病例为4个月, Ⅲ 级病例为3个月; 在再次SRS组, 分别为4个月、4.5个月以及9个月, 具有生存期提高的趋势。基于GPA评分, 再次WBRT组的中位OS为 3个月(0~1.0分)、4.5个月(1.5~2.0分)、7个月(2.5~3.0分); 再次SRS组中位OS分别为9个月、4个月和5个月。基于 KPS评分对WBRT组的生存分析显示, KPS< 50%病例的OS (1.5 个月) 明显差于KPS≥ 50%的病例(5.0 个月), 两组比较的风险比为6.67, 95% 可信区间2.01~22.09; P=0.001 9。认为KPS< 50%与OS状态明显相关, 是生存的负性预测因子。
• 毒性:PCI至再次WBRT的中位时间是14个月(4~42个月), 早期毒性发生于治疗8周内, 轻至中度恶心、头痛、脱发、乏力。72%病例使用类固醇激素治疗。所有不良反应为1~2级。
接受过PCI的SCLC脑转移患者行再次脑放疗对于症状缓解可获益, 并且副反应轻。数据提示对于PS状态足够好的患者有益。
PCI在SCLC的治疗中具有重要地位。局限期SCLC患者在放化疗后达到完全缓解者, 需给予PCI治疗, 这已是目前中外各大指南推荐的标准治疗。这主要是基于一项Meta分析结果、4项研究数据的汇总分析和一项回顾性分析的结果, PCI可以降低死亡风险6%~16%, 降低脑转移发生风险54%~55%, 增加放疗剂量并不能带来生存获益, 25 Gy/10 F依然是PCI的标准剂量[1, 2, 3]。
2007年, EORTC研究显示[4], 广泛期SCLC患者缓解后行PCI可使有症状脑转移发生率由40.4%降低至14.6%, 1年生存率由13.3%增高至27.1%。因此, 广泛期SCLC的PCI也一度作为Ⅰ 类证据推荐。
然而, 在PCI后20.6%的SCLC仍然常见脑转移发生或单纯以颅内病灶增大为表现的疾病进展, 此时手术、药物治疗等手段和疗效相对有限, 因此本文对这类预后差的患者提供了一种挽救性治疗方法的依据。
46例局限期SCLC和30例广泛期SCLC患者接受PCI后的脑部再放疗(WBRT 67例, SRS 13例)可增加3个月中位OS获益; KPS与OS状态明显相关, KPS< 50%的患者OS (1.5 个月) 明显差于KPS≥ 50%的病例(5.0 个月), 两组比较的风险比为6.67, P=0.001 9, GPA评分高的患者OS获益有延长的趋势。PCI至再次WBRT的中位时间是14个月, 早期毒性发生于治疗8周内, 所有不良反应为1~2级, 而40%患者再次脑放疗后症状缓解。由此提示, SCLC患者PCI 14个月以后再次脑放疗可以给PS状态好的SCLC患者带来生存获益, 安全有效, 尤其可以缓解症状, 保证生活质量, 这对终末期患者的意义可能更为重大。
但该项研究是单中心回顾性研究, 时间跨度长达7年, 且为单臂的再放疗组患者数据, 缺少没有接受再放疗患者的生存情况作对比, 因此对该研究结果的解读需要慎重对待。
然而该研究更重要的意义在于为我们对SCLC脑转移复发的研究和治疗提出了一些新的思考。
PCI后挽救性脑放疗的技术, WBRT和SRS该如何选择?研究提示只要再次WBRT距PCI时间超过14个月, 安全性是可以接受的, 但从疗效上看, SRS组相对于WBRT组中位OS可以再延长2个月, 当然这不排除两组样本量均较少且差异较大, 此外接受SRS治疗的患者脑转移灶数量小于4, 平均KPS=80%, 本身是预后相对较好的一组人群等偏倚因素的影响。但我们也要注意, 67例WBRT中有8例未完成放疗, 且所有患者PCI的剂量是30 Gy/15 F, 高于现有的标准PCI剂量, 这是否会影响PCI后WBRT无法顺利完成, 进而影响到生存期呢?未来是否可以开展前瞻性的研究比较其他不同放疗技术对脑转移灶的疗效?
由此引发的第二个问题是, 从全程管理的角度思考, 考虑到患者未来因脑转移疾病进展后的有限的治疗选择和有限的生存获益, PCI究竟要不要做, 怎样给后续治疗留有余地, 即PCI适合哪些人群?对局限期SCLC而言, 看似并没有太大分歧。但一项349例回顾性亚组分析表明[5], Ⅱ /Ⅲ 期的SCLC术后患者可以从PCI治疗中获益(Ⅱ 期:36.4个月vs. 24.05个月, 风险比0.54; Ⅲ 期:29.34个月vs. 21.16个月, 风险比0.54), 但Ⅰ 期SCLC患者PCI不能降低脑转移风险, 也不能改善患者的OS(风险比1.61, P=0.282)。另一项最新发表的658例局限期SCLC患者的回顾性分析表明[6], PCI组较非PCI组可以降低死亡风险(风险比0.73)和脑转移发生率(风险比0.54), 但在年龄> 70岁的亚组, PCI未能使患者的OS获益。而随着诊断技术的进步, 初始PET/CT分期和MRI随访也进一步提高对脑转移灶的发现。没有初始PET成像的患者接受PCI后脑转移风险降低(13.3% vs. 37.0%, P= 0.020), 但有初始PET成像的患者即使没有行PCI也能实现长期生存(5年生存率, PCI组 38.3%, 无PCI 组38.6%)[7]。同样, 对于广泛期SCLC而言, 最近发现奠定广泛期SCLC患者PCI地位的EORTC研究在设计上存在很多问题。今年发表的来自日本的多中心前瞻性随机对照研究显示[8], 虽然广泛期SCLC患者缓解后行PCI治疗能降低脑转移发生率(P< 0.000 1), 但是未能改善患者的OS(P=0.094)。似乎PCI这一曾经的标准治疗方法, 开始面临诸多挑战。
此外, 如何平衡脑放疗的疗效和神经认知功能损害之间的平衡也是难点问题, 尤其是PCI后的再次的挽救性脑放疗, 如何把握技术方式的选择、治疗介入的时机、剂量调整都至关重要。本研究中PCI的剂量已经高于标准, 再次的WBRT和SRS对患者神经认知功能状态的影响, 我们不得而知。
SCLC发生脑转移离不开全身系统性药物治疗, 尽管本研究把额外治疗和颅外病灶状态纳入RPA和GPA评分, 可能因样本量的关系, 并没有就首次诊断时局限期和广泛期SCLC分别分析, 颅内外病灶对治疗反应的变化是否一致, 是研究肿瘤转移的良好模型, 更是肿瘤异质性的体现, 同样也会在一定程度上影响生存。
要完美诠释以上问题, 可能更重要的是需要甄别出脑转移高危人群, 已有单变量和多变量分析报道显示[9], 胸部超分割加速放疗和TNM分期(Ⅲ B和Ⅳ 期)是PCI后脑转移的独立危险因素(P< 0.05), 因此有研究建议对局限期SCLC把PCI提前至胸部放疗之前。但相信未来应该是从细胞分子改变、脑组织微环境特征和调节机制上去深入探索SCLC脑转移, 区分孤立脑转移和全身进展患者之间的分子机制, 选择针对性的放疗技术或联合治疗方法。
关于本研究结果如何转化到临床实践, 目前而言对于距PCI超过1年以上、PS评分好、脑转移灶不超过5个以上的SCLC患者, 为改善症状, 对进展的脑转移灶实施SRS不失为一种可选择的姑息性治疗方法之一。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|