作者简介: 麦丽萍(1985-),女,广州人,主管技师,医学硕士,主要从事Ⅰ期临床试验工作。
目的 观察健康人体对注射用重组人胸腺肽α1皮下注射的耐受性与安全性,采用剂量递增方案,确定单次及连续给药的安全剂量范围。方法 单次给药48例健康受试者入组试验,其中36例分别皮下注射0.3 mg/m2、0.6 mg/m2、0.9 mg/m2、1.4 mg/m2、2.0 mg/m2、2.7 mg/m2注射用重组人胸腺肽α1,12例注射相应剂量的注射用水作为安慰剂;连续给药12例健康受试者分别皮下注射2.0 mg/m2、2.7 mg/m2注射用重组人胸腺肽α1,每周给药2次,连续4周。用药后对受试者进行临床观察和实验室检查,评价试验药物在人体的安全性。结果 单次给药48例健康受试者入组并完成试验,所有受试者均未出现不良事件。连续给药12例健康受试者入组并完成试验,其中,有5名受试者出现不良事件,其中3例出现大便潜血阳性,1例出现血红蛋白尿,1例受试者出现大便潜血阳性和血红蛋白尿。停药后于随访期复查恢复正常, 均无特殊处理, 自行好转。结论 单次应用注射用重组人胸腺肽α1 0.3~2.7 mg/m2是安全的,耐受性良好;连续使用4周,每周2次,剂量在2.7 mg/m2内是基本安全的。
Objective To evaluate the safety, tolerance and make sure the safe dose range of single dose and continuous hypodermic injection Recombinant Human Thymosin Alpha-1 (rh-thymosinα1) in Chinese healthy volunteers.Methods48 healthy volunteers were received a single dose group, including 36 subjects hypodermic injection of 0.3 mg/m2,0.6 mg/m2,0.9 mg/m2,1.4 mg/m2,2.0 mg/m2,2.7 mg/m2 rh-thymosinα1, 12 subjects hypodermic injection of the same dose water as placebo. 12 subjects in continuous dose group were hypodermic injected 2.0 mg/m2 or 2.7 mg/m2 rh-thymosinα1, two times a week, continue for four weeks. Safety and tolerance were evaluated by monitoring adverse events and laboratory parameters.Results48 healthy volunteers actual finished in a single dose group. There were no adverse events taken place in a single dose group. 12 healthy volunteers actual finished in a continuous dose group. There were 5 adverse events taken place in a continuous dose group, including 3 subjects fecal occult blood(FOB), 1 subject haemoglobinuria, 1 subject FOB and haemoglobinuria. All of them returned to normal after drug withdrawal in follow-up phase. Conclusion Rh-thymosinα1 from 0.3 mg/m2 to 2.7 mg/m2 hypodermic injection of single dose was safe and well tolerance.Continuoususing for four weeks, two times a week and the dose in 2.7 mg/m2 were safe.
注射用重组人胸腺肽α 1是由大肠杆菌系统表达, 再经层析技术纯化而得的由28个氨基酸组成的短肽, 属生物制品第13类新药。体外试验显示其通过刺激外周血液淋巴细胞丝裂原来促进T细胞的成熟, 增加抗原或丝裂原激活后T细胞分泌的α 干扰素、干扰素γ 以及白介素2、白介素3等淋巴因子水平; 同时增加T细胞表面淋巴因子受体水平; 还通过激活CD4细胞, 来增强异体和自体的人类混合淋巴细胞反应。临床上主要用于乙型肝炎、原发性和继发性免疫缺陷、艾滋病病毒感染、丙型肝炎以及作为疫苗的佐剂治疗[1, 2, 3, 4]。本研究旨在评价健康志愿者单次和连续皮下注射注射用重组人胸腺肽α 1的人体安全性、耐受性, 为进一步临床试验和应用提供依据。
1.1.1 入选标准
年龄在 18~40岁的中国健康志愿者, 男女性各半; 同一批受试者年龄不得相差 10岁以上; 体重:男性受试者不低于50 kg, 女性受试者不低于45 kg; 体质量指数(body mass index, BMI)在19~24 kg/m2范围内; 全面健康体检合格, 受试药物皮试阴性。筛选前在被告知所有与药物有关的可能的不良反应后, 自愿参加本试验, 并签署知情同意书。
1.1.2 排除标准
重要脏器有原发性疾病者; 精神疾患或躯体上的残疾者; 药物滥用者; 过敏体质, 临床上有显著的变态反应史, 或对两种或两种以上药物或食物过敏者; 或已知对日达仙、甘露醇、磷酸氢二钠和磷酸二氢钠过敏者; 怀疑或确认有酒精、药物滥用者; 试验前2周内曾用过某种中西药者; 最近3个月献血者及参加其他临床试验或打算在试验后1个月内进行献血者; 妊娠期妇女或可能妊娠的妇女。
注射用重组人胸腺肽α 1:规格1.6 mg; 批号20110401。由江苏海王生物制药有限公司提供。
1.3.1 单次给药耐受性试验剂量递增方案
根据临床前研究表明:注射用重组人胸腺肽α 1在小鼠体内的急性毒性半数致死剂量(median lethal dose, LD50)> 20 mg/kg, 根据动物 LD50的 1/600计算确定注射用重组人胸腺肽α 1单次给药最小剂量: 20 mg/kg× 1/600× 60 kg=2.0 mg。其大于注射用胸腺肽的常用剂量。注射用胸腺肽的说明书中常用剂量为1.6 mg(900 ug/m2), 取其1/3并结合药物规格, 确定注射用重组人胸腺肽α 1的初始剂量为0.3 mg/m2。
结合临床前动物试验和临床用药推荐剂量以及同类产品注射用胸腺肽说明书中安全性描述内容, 按照费氏递增法进行剂量递增设计, 确定注射用重组人胸腺肽α 1单次给药最大剂量定为2.7 mg/m2。参照费氏递增法递增, 单次给药分别为0.3 mg/m2、0.6 mg/m2、0.9 mg/m2、1.4 mg/m2、2.0 mg/m2、2.7 mg/m2。每组6~8人。
本研究采用组内随机的方法, 每次仅筛选一组受试者, 均为男女各半, 确定入选受试者后按照性别分层, 采用摸球法进行随机分组。按表1剂量进行逐组试验, 每组以4人为一单元(3例受试药+1例安慰剂)的方式进行, 男女各半。同一剂量组内采用分层随机方法:若第一单元安慰剂为男性, 则受试药为1男2女; 若第二单元安慰剂为女性, 则受试药为2男1女。
| 表1 单次给药剂量递增方案 |
1.3.2 多次给药耐受性试验剂量递增方案
根据单次给药耐受性试验的最大耐受剂量, 以次大剂量组(如2.0 mg/m2)为连续给药耐受第一组, 先选择6名受试者进行观察, 若试验中未见剂量限制性毒性(dose limited toxicity, DLT), 则再选择6名受试者上升一个剂量(即用最大耐受量2.7 mg/m2)进行安全性和耐受性考察; 若连续耐受第一组中有超过1/6受试者出现DLT, 则再选择6名受试者下降一组(1.4 mg/m2)进行安全性和耐受性考察。
1.3.3 给药方法
注射用重组人胸腺肽α 1, 用1 mL灭菌注射用水溶解后取相应体积药液立即于右上臂部皮下注射。
本试验方案获广东省人民医院伦理委员会批准后进行。符合入选标准的健康受试者随机分配至各试验组, 男女各半。单次给药每个剂量组均随机选择一男一女两名受试者皮下注射注射用水作为安慰剂。试验前 12 h入住Ⅰ 期临床试验病房。给药当日早晨, 受试者空腹皮下注射试验药或安慰剂, 给药量按体表面积计算, 给药后于不同时间点监测生命体征变化。试验期间禁止剧烈活动, 禁止吸烟、饮酒及饮用含酒精、咖啡因或碳酸类饮料, 禁用任何试验外药物。从初始剂量开始, 按剂量递增顺序逐组进行试验; 综合评估临床与实验室检查, 充分考虑受试者安全, 证实在可耐受的情况下, 方可进入下一剂量组试验。单次给药耐受性试验结束后才开展连续给药耐受性试验。连续给药组每周给药2次, 连续4周。
1.5.1 临床观察及体格检查
每组每次给药前、给药后1 h、2 h、3 h、4 h、6 h、8 h、12 h和24 h进行生命体征监测(坐位血压、脉搏、腋下体温、呼吸频率)、体格检查(包括神经系统、呼吸系统、心血管系统、消化系统、皮肤变化、意识及精神状态)以及不良事件观察。
1.5.2 实验室检查
单次给药组进行筛查和给药后次日共两次检查; 连续给药组进行筛查、给药第4次48 h内、给药第8次48 h内共3次检查。实验室检查包括血常规、尿常规、大便常规+隐血; 血生化检查包括丙氨酸氨基转移酶、天冬氨酸转移酶、碱性磷酸酶、谷氨酰转移酶、总胆红素、结合胆红素、肌酐、尿素氮、总蛋白、白蛋白、总蛋固醇、电解质等; 凝血酶原活动度、部分凝血活酶时间、凝血酶时间、纤维蛋白原; 免疫球蛋白A、免疫球蛋白M、免疫球蛋白G。
1.5.3 不良反应
对所有临床试验过程中出现的不良事件, 及时处理并详细记录, 定期复查, 直至所有不良事件消失。对于不良事件、异常实验室检查和其它检查异常结果, 按肯定有关、很可能有关、可能有关、可疑、不可能有关5级评定不良事件与试验药物的关系。如发生严重不良事件, 应及时处理并上报相关部门。
计量资料采用均数 ± 标准差进行统计描述; 采用SPSS 17.0统计分析软件; 与入选基础值进行比较, 采用配对t检验比较前后差异; 与安慰剂组比较, 采用独立样本t检验比较两组间的差异; 多组之间采用ANOVA分析。
本研究经过6个剂量组单次给药耐受性试验和2个剂量组的连续给药耐受性试验, 共观察受试者60例。
单次给药完成6个剂量组, 入组健康受试者48例。其中0.3 mg/m2组6例、0.6 mg/m2组6例、0.9 mg/m2组6例、1.4 mg/m2组6例、2.0 mg/m2组6例、2.7 mg/m2组6例, 安慰剂12例, 均未出现DLT。48例健康志愿者年龄 21~31岁[(24.3± 2.3)岁], 身高153~180 cm[(164.4± 7.1)cm], 体重 46.0~72.0 kg[(57.2± 6.8) kg], 体表面积1.50~1.95 m2 [(1.7± 0.1)m2]。
连续给药完成2个剂量组, 第一组(2.0 mg/m2)完成6例, 第二组(2.7 mg/m2)完成6例, 均未出现DLT。连续给药组12例受试者年龄 20~28岁[(22.8± 2.2)岁], 身高150~180 cm [(164.6± 8.2) cm], 体重45.5~70.0 kg[(56.8± 6.7) kg], 体表面积1.46~1.96 m2[(1.7± 0.1)m2]。
各试验组一般情况比较差异无统计学意义。整个研究均未违背临床试验方案。
单次耐受各组受试者给药后均无不适主诉, 所有受试者均无不良事件发生。
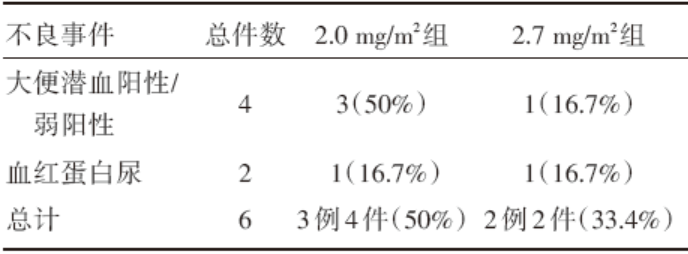
连续给药2.0 mg/m2剂量组有3名受试者出现不良事件, 其中2名受试者表现为大便潜血阳性, 1名受试者表现为大便潜血阳性和血红蛋白尿, 与药物的关系均为无法判断。2.7 mg/m2剂量组2名受试者出现不良事件, 表现为大便潜血弱阳性1例, 血红蛋白尿1例, 与药物的关系均为无法判断, 见表2。
本研究中所有受试者在试验期间未见体温、脉搏、呼吸、血压等出现异常波动, 生命体征在给药前后差异无统计学意义。
| 表2 连续给药不良事件发生率 |
统计分析结果显示: 单次耐受各剂量组与安慰剂、各剂量组试验前后实验室检查差异均无统计学意义。
连续给药各组大部分指标给药前后的差异没有统计学意义; 个别指标的差异虽有统计学意义, 但其数值都在正常范围内, 无临床意义。
各试验组受试者给药前后心电图检查均无明显异常改变。
注射用重组人胸腺肽α 1与已上市药品注射用胸腺肽α 1(商品名日达仙)结构相似。其与日达仙的结构差异在于日达仙为乙酰化产品, 而注射用重组人胸腺肽α 1为去乙酰化后的日达仙成份。日达仙进入人体后首先去乙酰化, 转化为本研究药物后起效, 因此, 两者的作用机制是一致。故本研究药物与日达仙可能有相同的不良反应:部分患者可有注射部位不适、疼痛, 极少情况下有红肿、短暂性肌肉萎缩、多关节痛伴有水肿、皮疹。慢性乙肝患者接受本品治疗时, 可能出现丙氨酸氨基转移酶水平一过性上升等[5]。
本研究中所有受试者均未出现上述不良反应, 单次给药组采用剂量递增方案, 完成了0.3 mg/m2、0.6 mg/m2、0.9 mg/m2、1.4 mg/m2、2.0 mg/m2、2.7 mg/m2共6个剂量, 均未出现不良事件, 表明健康人体对此药单次最大耐受剂量是2.7 mg/m2, 在此剂量内临床使用较安全。
连续给药组共有5名受试者出现不良事件, 其中3例出现大便潜血阳性, 1例出现血红蛋白尿, 1例受试者出现大便潜血阳性和血红蛋白尿。上述事件均为一过性, 试验后7天内连续复查3次均为正常。本研究中出现血红蛋白尿的受试者为女性, 且检查时该受试者刚结束生理期, 异常结果与尿液生理期污染可能相关[6]。文献报道[7], 出现大便潜血结果阳性的原因较多, 结合本研究情况, 受试者无痔疮病史, 无消化道出血的临床症状, 生物制品未见有导致大便潜血、血红蛋白尿的类似报道, 故无法判断其与药物的关系。因此, 该制剂的 Ⅱ 期临床试验皮下注射剂量可在2.7 mg/m2以内, 2次/周, 较为安全, 但仍需要关注大便常规及尿常规等实验室检查与药物的关系, 并注意进一步观察不良反应。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|