作者简介: 张继云(1974-),女,江苏宿迁人,硕士研究生,从事风湿病学研究。
目的 研究活动期系统性红斑狼疮患者维生素D水平与内皮祖细胞数量及功能的相关性,揭示系统性红斑狼疮发生动脉粥样硬化的内在原因。材料与方法 收集30例系统性红斑狼疮活动性指数评分大于8分、病情均处于活动期的系统性红斑狼疮患者,30例年龄与性别匹配的健康人作为正常对照组;酶联免疫吸附试验检测外周血25羟基维生素D水平;密度梯度离心和贴壁培养法分离培养内皮祖细胞,流式细胞术检测CD3+/CD4+/VEGFR-2+内皮祖细胞在全血中的比例;通过计数再贴壁和构建侵袭小室检测内皮祖细胞粘附和迁移能力。结果 ①活动期系统性红斑狼疮患者外周血25羟基维生素D(14.47±10.39) ng/mL水平低于健康对照组(24.15±7.98) ng/mL,差异有统计学意义(P<0.05);②体外培养过程中,活动期系统性红斑狼疮患者内皮祖细胞数量(0.028%±0.017%)显著低于正常对照组 (0.067%±0.012%);活动期系统性红斑狼疮患者内皮祖细胞迁移率[(1.7‰±0.9‰)vs.(3.1‰±1.6‰)]及粘附能力[(19±7)vs. (34±11)]显著低于正常对照组,差异有统计学意义(P<0.05);③活动期系统性红斑狼疮患者25羟基维生素D水平与内皮祖细胞数量、迁移及粘附功能均呈正相关(P<0.05)。结论 系统性红斑狼疮患者维生素D缺乏与内皮祖细胞数量和/或功能异常有关,参与了血管内皮的损伤以及修复障碍,从而增加了动脉粥样硬化发生的风险。
Objective To investigate the relationship between vitamin D and endothelial progenitor cells in patients with active systemic lupus erythematosus (SLE), and to reveal the intrinsic causes of atherosclerosis in SLE.Methods Thirty consecutive patients (SLEDAI score≥8) were in the active phase of SLE who attended the in-patient clinic of our hospital and 30 age and sex-matched healthy people as controls. Ezyme linked immune sorbent assay(ELISA) was used to detect the levels of 25-Dihydroxyvitamin D[25(OH)D]in peripheral blood. Isolation and culture of endothelial progenitor cells(EPC)by density gradient centrifugation and adherent culture. CD3+/CD4+/VEGFR-2+EPC numbers were determined by flow cytometry. Migration and adhesion of EPCs were observed by transwell migration assay. Statistical analysis was conducted with t-test and Mann-Whitney rank test.Results ① The level of peripheral blood 25(OH)D in patients with active SLE (14.47±10.39) ng/mL was lower than normal controls(24.15±7.98) ng/mL (P<0.05). ②In active SLE subgroups, the number of EPC(0.028%±0.017%) were significantly lower than normal controls (0.067%±0.012%) (P<0.05). The migration rate of EPC from active SLE patients(1.7‰±0.9‰) were significantly reduced as compared with normal controls(3.1‰±1.6‰) (P<0.05). The adhesion of EPCs from active SLE patients(19±7)were declined as compared with normal controls(34±11)(P<0.05). ③The level of peripheral blood 25(OH)D was positively correlated with the number of EPC in active SLE(P<0.05). The level of peripheral blood 25(OH)D was positively correlated with the migration and adhesion of EPC in active SLE(P<0.05).Conclusion The study demonstrate an association between EPC reduction/dysfunction and vitamin D insufficiency in SLE patients, which results in endothelial dysfunction and atherosclerosis. These findings can provide strong rationale for atherosclerosis therapy in SLE.
系统性红斑狼疮(systemic lupus erythematosus, SLE)是自身免疫病的原型疾病, 由于对疾病发生机制的重新认识和新治疗方法的应用, 近年来患者的生存期有了很大的提高。但是, 在既往导致患者死亡原因如感染、肾功能不全等得到控制的同时, 动脉粥样硬化相关的致死致残率却在逐步增高[1, 2]。SLE患者中动脉粥样硬化发生时间早且病情严重[3, 4], 即使在去除传统的风险因子影响后狼疮患者发生冠心病的相对风险仍高达8~10倍[5], 传统的危险因素难以完全解释SLE患者增高的心血管病危险性, 这说明狼疮自身就是促进动脉粥样硬化发生的危险因素, 目前尚不清楚狼疮通过何种机制促发或加重动脉粥样硬化。
维生素D的主要生理学功能是调节机体的钙和骨代谢。近年来随着认识的深入, 发现其具有广泛的免疫调节作用[6]。SLE患者体内存在维生素D的缺乏, 维生素D水平与病情活动度及肾损害明显相关, 可能参与了SLE的发病[6, 7, 8]。维生素D受体存在于内皮细胞, 维生素D缺乏会影响血管内皮的功能, 进而导致动脉粥样硬化的发生发展。有文献报道, 在狼疮患者中内皮细胞凋亡增加并存在功能障碍, 且与颈动脉内中膜厚度相关[9, 10, 11, 12], 提示SLE可通过损伤内皮细胞而诱发动脉粥样硬化。本研究旨在验证维生素D的免疫学作用, 并深入探索维生素D对狼疮患者内皮祖细胞(endothelial progenitor cells, EPC)的影响, 以揭示SLE早期发生动脉粥样硬化的内在机制, 从而为临床防治疾病、提出新的治疗方案和发现新的药物作用靶点打下基础, 最终达到延长患者生存期、减少致残率的目标。
收集2014年7月至2016年7月新疆医科大学第二附属医院风湿免疫科治疗的30例SLE患者, 年龄24~44岁, 平均(34.2± 9.6)岁, 其中女性27例、男性3例, 诊断均符合1997年美国风湿病学院修订的SLE分类标准, 以SLE 活动性指数(SLE disease activity index, SLEDAI) 评分作为病情活动判断的标准[4], SLEDAI评分大于8分, 病情均处于活动期; 30例新疆医科大学第二附属医院体检中心的健康人群作为正常对照, 年龄28~45岁, 平均(36± 8.5)岁, 其中女性25例、男性5例, 均无风湿病史和风湿病家族史。各组间年龄、性别差异均无统计学意义。
1.2.1 外周血维生素D水平检测 采集受试者空腹静脉血4 mL于普通离心管, 分离血清, 4 ℃保存, 3天内完成25-(OH)维生素D的检测。通过酶联免疫吸附试验(ELISA), 采用25(OH)维生素D检测试剂盒、RT-6100酶标分析仪, 严格按照试剂盒及仪器操作说明对样本进行检测。
1.2.2 EPC分离、培养和鉴定 抽取外周血20 mL, 用密度梯度离心法获取单个核细胞, 将其铺在包被有人纤连蛋白的24孔培养板上, 用EBM-2培养基[含20%胎牛血清, 血管内皮生长因子(VEGF)50 ng/mL, SCF 50 ng/mL, 青霉素100 U/mL, 链霉素100 U/mL]在37℃、CO2饱和湿度的培养箱中培养, 4天后换液, 弃未贴壁细胞, 7天左右收集贴壁细胞。取贴壁细胞与DiL标记的乙酰化低密度脂蛋白(DiL-AcLDL, 终质量浓度为2.4 mg/L)37℃孵育1小时, 2%多聚甲醛固定细胞10分钟, PBS浸洗; 加FITC标记的荆豆凝集素1(FITC-UEA-1, 终质量浓度10 metE)37 ℃孵育1小时。于倒置荧光显微镜下观察并计数, DiL-AcLDL并FITC-UEA-1双染色者为EPC细胞。
1.2.3 流式细胞检测 EPC 数量 入院者清晨空腹取2 mL静脉血, 置于肝素锂抗凝的真空常规管中, 移液枪取100 μ L全血加入离心管中, 加入膜抗体[10 μ L CD3/CD4单克隆抗体, 5 μ L CD309(VEGFR-2)单克隆抗体], 以同型抗体作对照, 室温避光保存30 分钟; 加 2 mL 溶血素混匀, 室温避光放置 5分钟; 以1 500 r/min离心 5 分钟, 采用流式细胞仪检测CD3+/CD4+/VEGFR-2+ EPC在全血中所占比例。
1.2.4 EPC迁移能力检测 上述细胞培养7天后, 以0.25%胰蛋白酶消化, 收集贴壁细胞并计数。将5× 104细胞悬浮于100 μ L培养液, 注入改良Boyden小室的上室, 另将含血管内皮生长因子的200 μ L培养液注入下室, 细胞培养箱中培养6小时后取出微孔滤膜, 固定染色后在显微镜下计数迁移到低层的细胞。
1.2.5 EPC粘附能力检测 EPC培养7天后收集细胞, 悬浮于培养液计数后, 以5× 104细胞/孔加入纤维连接蛋白包被的24孔培养板, 至细胞培养箱中1小时, 以倒置显微镜计数贴壁细胞。
内皮细胞生长培养基-2(EBM-2)、人血管内皮生长因子(VEGF)均购自美国Lonza公司; 人纤维连接蛋白(HPF, 美国Millipore公司); 1, 17-双十八烷基-3, 3, 3’ , 3’ -四甲基吲哚羰基花青高氯酸盐(Dil)标记的乙酰化低密度脂蛋白(DiI-ac-LDL, 美国Molecular Probe公司); 异硫氰酸荧光素(FITC)标记的荆豆凝集素(FITC-UEA.1, 德国Vector公司); 基质胶(Matrigel, 美国BD公司); FACS Calibur型流式细胞仪(美国BeetonDiekinson公司)。
采用SPSS 11.5软件进行数据统计分析。计量资料用(\(\overline{x}\) ± s)表示。按照分组进行方差齐性分析, 方差齐行独立样本t检验, 方差不齐行Mann-Whitney秩和检验, 分析相关性时, 采用双变量相关分析。P< 0.05为差异有统计学意义。
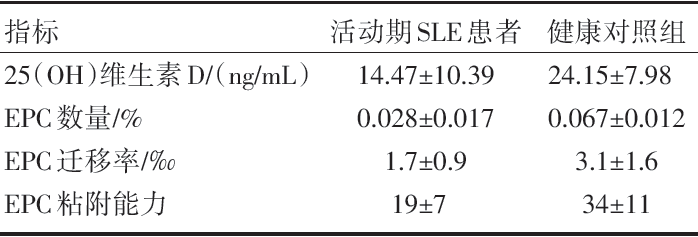
活动期SLE患者外周血25(OH)维生素D水平低于健康对照组, 差异有统计学意义(P< 0.05), 见表1。
| 表1 活动期SLE 患者和健康对照组25(OH)维生素D 水平及EPC 数量和功能比较 |
体外培养过程中, 活动期SLE患者EPC数量显著低于正常对照组, 差异有统计学意义(P< 0.05), 见表1。
体外培养过程中, 活动期SLE患者EPC迁移率及粘附能力显著低于正常对照组EPC迁移率及粘附能力, 差异有统计学意义(P< 0.05), 见表1。
活动期SLE患者25(OH)维生素D 水平与EPC数量呈正相关(r=0.345, P< 0.05); 活动期SLE患者25(OH)维生素D 水平与EPC迁移及粘附功能呈正相关(r=0.475, r=0.56, P< 0.05)。
维生素D的经典作用与钙磷代谢有关, 维生素D对肾脏、肠道和骨骼的作用受到严格调控, 以维持正常血钙和骨骼矿化。维生素D 在包括免疫系统、骨骼肌肉和心肌、胰腺β 细胞以及皮肤在内的目标组织中还有非经典作用。维生素D对免疫系统的作用同时影响着先天和适应性免疫系统。免疫系统内维生素D受体的广泛表达, 多种免疫细胞合成与分泌25(OH)维生素D(维生素D的体内活性形式) [6, 13], 提示维生素D在免疫过程中发挥着重要的作用。
SLE是在遗传及环境因素的共同作用下机体发生免疫异常进而产生的疾病, 维生素D免疫调控效应已证实同样存在于SLE[14, 15], SLE患者常伴随维生素D降低, 并与病情活动度、狼疮临床诊断和评价疾病活动的指标Ⅰ 型干扰素呈负相关[16], 临床研究表明补充维生素D可增加调节性T细胞, 减少记忆性B细胞及抗dsDNA抗体, 逆转SLE免疫异常[7], 进一步说明维生素D在SLE中有着不可忽视的地位。我们通过检测活动期SLE患者体内的血清25(OH)维生素D水平, 发现明显低于健康对照组, 说明SLE患者体内维生素D水平是降低的, 维生素D与SLE的发病有关, 这与之前的研究结果一致。
在正常情况下, 当机体出现内皮损伤时, 循环血中的EPC可到达损伤部位, 粘附于受损血管表面, 进行损伤修复。EPC来自骨髓, 源于造血干细胞或与之具有共同的起源。越来越多的证据表明, EPC作为血管内皮细胞的前体细胞, 可以动员到外周血, 通过自身分化和旁分泌内皮生长因子等途径在血管内皮损伤和修复过程中发挥极其重要的作用, 从而防止或延缓动脉粥样硬化的进展。相反, EPC的数量减少和功能受损均可导致与动脉粥样硬化有关的疾病发生。研究显示, 冠心病患者循环血EPC较正常人减少约50%并且迁移能力较低, EPC数量与冠心病患病率呈负相关; 在动物模型中, 体内动员或输注体外扩增的EPC可促进重新内皮化, 改善内皮功能, 抑制动脉粥样硬化斑块形成[17, 18]。近几年, 数篇国外文献同时报道EPC数目在SLE患者外周血中明显减少[19, 20, 21, 22]。我们的研究通过分离培养活动期SLE患者外周血EPC, 结果表明其数量显著低于健康对照组, 与国外报道相符。同时发现EPC粘附、迁移功能较健康对照组也是明显下降的, 并且通过相关性分析发现, 活动期SLE患者维生素D的水平不足与EPC数量及功能的下降呈正相关, 提示SLE患者动脉粥样硬化的发生与维生素D缺乏有关。
维生素D对动脉粥样硬化影响的机制尚未完全清晰, 已有报道认为动脉血管内皮可通过其上分布的各种受体起到各种调节作用, 并且对血管壁具有一定的保护作用, 动脉粥样硬化是在内皮损失后机体作出的一种反应。血管内皮生长因子抑制体外培养的血管内皮细胞主要是通过诱导抗凋亡蛋白Bcl-2和其相关蛋白A1的表达, 但有研究发现, 维生素D可上调促进细胞凋亡的P53基因表达, 下调抗凋亡蛋白Bcl-2, 诱导内皮细胞凋亡进一步损失血管内皮细胞, 增加动脉粥样硬化风险[23]。我们的研究显示, 活动期SLE患者维生素 D水平与EPC的数量及功能相关, 推测在SLE患者体内, 维生素D水平低于正常水平, 可造成EPC功能的下降, 减弱其参与维持、保护血管内皮功能的作用, 促进了动脉粥样硬化的发生。维生素D缺乏可能是SLE引起动脉粥样硬化的重要原因之一, 其具体机制有待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|