编者按: 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心,吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗,开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊,临床、病理、B超、放射影像等资料齐全,除相关科室提前准备的中心性发言外,到会人员各抒己见,气氛热烈。参会人员受益匪浅,提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去,让更多的临床医生获益,我刊开辟“循证病例讨论”栏目,希望广大医务工作者关注此栏目。
患者张某, 男, 35岁, 因“ 突发不省人事1周” 在当地医院行头颅CT示:颅内占位病变, 于2008-08-22在我院神经外科就诊, 全麻下行右额胶质瘤开颅切除术, PS 1分。查体:神清, 双侧瞳孔等大等圆, 对光反射灵敏, 额纹、鼻唇沟对称, 伸舌居中。四肢肌力5级。否认糖尿病、高血压病史, 无吸烟、饮酒史。
手术记录:肿瘤下界与侧脑室相通, 显微镜下基本切除肿瘤。
术后病理(2008-08-27):右额叶星形细胞瘤, WHOⅡ 级。免疫组化:CgA(-), MGMT约60%(+), GFAP(++), Vim(+++), EMA(-), LCA(-), S-100(+++), Syn(-), Bcl-2(+), P53约30%(+), Ki67 < 5%(+)。
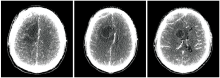
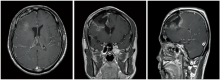
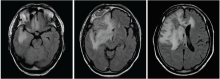
2008-09-09患者术后复查增强CT提示右侧额叶囊肿和软化灶, 图像见图1。
诊断:右额叶星形细胞瘤, WHOⅡ 级术后。
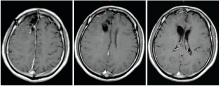
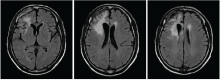
林辉(放疗科住院医师):病史汇报(略)。患者术后于2008-09-12在我科行术后单纯放疗(三维适形放疗), 56 Gy/28 F, 2 Gy/(F· 天)。患者放疗结束后未遵医嘱返院复查, 在当地不规律复查。2015年突发意识丧失伴肢体抽搐2次, 2016-06-15在汕头中心医院复查头颅MRI平扫+增强提示右额叶胶质瘤复发, 见图2和图3。
首先我们要讨论的问题是, 目前影像及临床考虑胶质瘤复发, 无进展生存期7.8年, 如何评价第一次治疗(手术+术后放疗)的疗效?
李伟雄(放疗科主任医师):该病例为Ⅱ 级星形胶质瘤, 患者年龄小于45岁, 肿瘤大小为< 6 cm, 未超过中线, 未有明显神经功能缺失。属于预后比较好的病例, 按照2008年当时的NCCN指南可以选择随访观察, 但是考虑患者家住外地, 依从性差, 难以遵医嘱规律随访; 而且, 2005年有研究显示:Ⅱ 级胶质瘤术后立即放疗虽然不能提高总生存期, 但延长了无进展生存期, 同时提高了癫痫的控制率。所以当时基于上述原因给患者采用术后立即放疗的方案。
旁述:中枢神经肿瘤2008年NCCN指南建议:对于能最大安全切除的成人低级别幕上星形及少突胶质瘤患者, 年龄大于45岁可以选择术后放疗或者术后化疗, 小于等于45岁的患者术后可以选择随访观察, 但是指南同时备注:对于选择随访观察的患者定期规律随访非常重要[1]。van den Bent 2005年发表在《Lancet》上的文章提示术后立即放疗能提高癫痫的控制率和无进展生存率[2]。
曹小龙(番禺市中心医院肿瘤科主任医师):患者病理提示为Ⅱ 级星形胶质瘤, 当时虽然没有做基因检测, 但是根据预后分型, 该患者应该属于预后比较好的患者, 可以选择观察或者接受术后放疗, 建议选用随访观察。
李伟雄:预后好的患者中位复发时间超过5年, 这期间应规律随访(每3个月复查头颅MRI检查), 而该患者依从性差, 综合考虑这些因素当时选择术后立即接受放疗。
郑登云(头颈肿瘤科主任医师):按照当时指南, 如果患者术后是完整切除的, 可以选择随访观察, 但是考虑患者当时术后仅接受头颅CT增强扫描, 未行MRI检查, 而且手术记录提示:肿瘤肉眼下和侧脑室相通, 同时考虑患者无法规律随访, 术后立即放疗能提高癫痫的控制率, 选择术后立即放疗也是一种可行手段。该病例的复发时间为7.8年, 明显超过文献报道的中位复发时间5.3年, 从现在的结果看, 立即放疗的疗效暂时是不错的。化疗暂时无明显证据能使患者获益, 建议暂时不行化疗。
谢松喜(放疗科副主任医师):文献中提示立即放疗和随访观察患者总生存是相同的, 仅无进展生存期在立即放疗患者中有优势, 但是两组患者总生存期一样, 是因为随访的患者复发后大部分接受了再次手术和放疗, 因此加起来的总生存期没有差异, 因此随访仅是推迟了放疗而已, 不是不做放疗, 考虑患者无法坚持规律随访, 当时考虑立即放疗也是可行的。
吴一龙(肿瘤学教授):该患者的中位复发时间明显超过了文献及临床研究显示的中位复发时间, 但是无法说明该患者中位复发时间长是因为患者接受了术后的立即放疗, 因为该患者无论是立即放疗或是随访观察, 其复发时间可能都超过文献报道的中位复发时间。但是不知道该患者当时是否接受了神经认知功能的评估, 如果有这部分资料, 即使无法回答该患者接受立即放疗是否会延长患者的生存期, 但是可以回答该患者接受了立即放疗后认知功能是否有下降, 这个数据比患者的无进展生存期更重要, 建议以后的患者尽量都接受神经认知功能的量表评估, 获得脑放疗后的神经认知功能数据。
李伟雄:因当时条件限制, 该患者未接受神经认知功能的量表评估。
旁述:低级别胶质瘤的生存预后因子主要是年龄、大小、是否过中线、组织类型、神经症状。通过这几个预后因子可以将低级别胶质瘤患者的预后分为低危和高危[3]。Daniels等进一步在真实世界患者中验证了这些预后因子。
中枢神经肿瘤NCCN 2016指南建议:对于能最大安全切除的低级别成人幕上星形及少突胶质瘤患者, 其中低危险因素(年龄≤ 40岁, 肿瘤大体完全切除)患者术后可以选择随访观察, 术后放疗或者术后化疗三者中的一种[5]。
林辉:按照最新的NCCN指南[5]对于放疗后复发的患者如果能再次手术首选手术, 患者2016-06-21在我院神经外科行“ 右额开颅肿瘤切除术” , 病理示“ (右额叶肿瘤)星形细胞瘤, 考虑为WHO Ⅱ 级” , 手术记录显示:在荧光显微镜下肿瘤主要位于上次手术腔的后方。下面请神经外科医生介绍胶质瘤的手术方式及复发后再切除的适应证。
郭文龙(神经外科副主任医师):手术方式目前比较先进的有术中神经导航、术中MRI和术中荧光显微镜辅助, 能保证尽量不损伤重要神经纤维束的前提下全切肿瘤。对于仅有影像学表现而无临床症状的复发胶质瘤患者可以选择立即手术, 也可以选择暂时观察, 如果患者有明显的神经系统症状且影像学考虑复发, 经过评估体能可以耐受手术的患者一般推荐立即手术。
林辉:患者再程手术术后病理免疫组化:P53(+), Ki67(约2%+), EMA(-), Bcl-2(++), S100(+), Vimentin(+++), GFAP(+++), Syn(++), CgA(-), MGMT(++), IDH1(+), VEGF(+), EGFR(+++), Olig2(+++), NeuN(残留神经元+)。基因检测提示:IDH1 R132H突变, IDH2(-), 1p/19q无缺失。最新中枢神经系统病理诊断里纳入了分子分型, 这对于胶质瘤的诊断、预后及治疗有哪些意义?
张明辉(病理科主治医师):最新的神经肿瘤第四版修订版在组织学表型外加入了分子分型, 当组织学表型有争议时, 分子学表型甚至胜于组织学表型。对于神经胶质瘤目前采用的常见分子检测是IDH基因、1p/19q染色体是否有共缺失、α -地中海贫血/智力缺陷综合征X染色体连锁基因(ATRX)是否有突变、MGMT启动子是否甲基化。ATRX突变、联合IDH突变及1p/19q状态, 有助于胶质瘤患者的预后评估。
旁述:IDH1(推荐克隆号:H09)基因第132位点的杂合突变出现于80%以上的低级别胶质瘤, 包括星形细胞瘤、少突胶质细胞瘤和少突星形细胞瘤以及继发性胶质母细胞瘤, 进一步研究显示IDH1突变型患者的预后明显好于野生型。因此, 对于IDH1基因突变的确定是病理学诊断和预后评估的重要参考指标[6, 7]。
ATRX(推荐Lot No:E97092, 多克隆)在大部分星形细胞胶质和混合型少突星形胶质瘤中表达缺失, 而在毛细胞型星形细胞瘤中未见表达缺失, 对鉴别毛细胞型和弥漫性星形细胞瘤具有重要的参考价值, 尤其是在小活检标本时[7, 8]。
MGMT为一种DNA修复酶。细胞内MGMT的水平直接反映了它耐受的DNA损伤程度。一般认为, 没有或低水平表达MGMT的肿瘤细胞对烷化剂类药物有效; 反之意味着耐药。利用免疫组化检测胶质瘤细胞MGMT活性操作简单易行, 但缺乏特异性, 因为MGMT在正常神经元、胶质细胞、淋巴细胞和血管内皮细胞广泛表达, 需要有经验的神经病理医生进行观察和计数。因此, 有条件的单位提倡采用PCR法对MGMT启动子基因甲基化进行检测, 结果更可靠[7- 9]。
1p/19q杂合性缺失的患者对烷化剂类抗肿瘤药物敏感, 无瘤生存期延长(Ⅰ 级证据)。目前, 检测1p/19q杂合性缺失的方法有PCR、FISH和CGH等[7]。
Cancer Genome Atlas Research Network于2015年发表在《N Engl J Med》上的研究显示, 根据组织病理和IDH基因是否突变, 是否有1p/19q共缺失比单纯组织学分级更能区分患者预后[10]。
2017年发表在《Lancet Oncol》的欧洲神经肿瘤协会指南提示[11], 对于WHO Ⅱ 级的胶质瘤, 根据基因情况, 如果有IDH基因突变建议随访观察; 如果无IDH基因突变, MGMT启动子无甲基化建议放疗, 而MGMT启动子有甲基化则建议行放疗加替莫唑胺化疗。
患者第二次术后病理报告是:星形细胞瘤, WHO Ⅱ 级, IDH1突变, 1p/19q无缺失。下一步该如何治疗?是放疗还是放化疗?
李伟雄:该病例术后复查MRI提示肿瘤未完全切除, 根据最新NCCN指南, 对于复发的低级别胶质瘤术后推荐先行辅助化疗, 疾病进展后再选择更换化疗方案的化疗、放疗或者最佳支持治疗, 但是我认为化疗对病灶的控制时间还是不如放疗, 术后优先推荐化疗主要是对再程放疗神经功能的损伤有所顾虑, 考虑到该病例放疗后近8年, 目前两次接受总剂量100 Gy的放疗剂量是安全的, 建议可以行术后放疗。
吴一龙:目前再程放疗的指征是什么?
李伟雄:主要的放疗指征是:两次放疗间隔2年以上, 复发病灶位于原来放疗野外, 复发的病灶较小, 再程放疗剂量学评估可以耐受。
谢松喜:从术后的MRI看, 患者术后肿瘤有明显残留, 手术医生认为未完整切除, 建议行术后放疗。
郭文龙:评价手术是否完全切除, 目前主要是通过术后MRI来评价, 从术后MRI看, 该病例是未完全切除。
黄飚(影像科主任医师):对于WHO Ⅱ 级的胶质瘤评价肿瘤主要看T2及T2 FLAIR图像, 该病例从影像学看术后残留可能性大。
曹小龙:如果外科及影像都认为有残留, 建议行术后放疗。
郭文龙:第一次术后如果是未完全切除一般推荐行术后放疗, 但是复发术后如果肿瘤有残留是否需立即接受放疗是有争议的, 但是接受放疗也是一种可选择的方案。
郑登云:该病例外科及影像学都认为术后肿瘤有残留, 根据指南可以先考虑化疗, 但是肿瘤病灶较大, 而且复发距离上次放疗时间较长, 有8年时间, 原来没有接受过化疗, 建议行放疗加上替莫唑胺化疗, 必要时可以加贝伐单抗减轻放疗水肿。
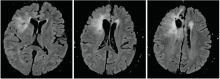
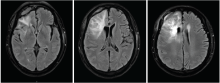
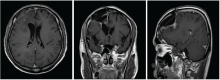
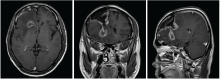
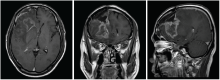
林辉:患者2016-07-20至2016-08-28行同期放化疗, 放疗:IMRT, DT:54 Gy/27F, 同期化疗:替莫唑胺75 mg/m2 qd。放疗后接受辅助化疗:替莫唑胺150 mg/m2 d1~d5, 6个疗程, 过程顺利, 放疗后定期复查。2017-02-18复查(再程放疗后6个月)提示病灶增大, 患者出现头痛, 无语言及四肢肌力异常。1个月后再次复查病灶进一步增大。给予口服激素治疗后患者头痛稍有减轻。患者2017-07-04再程术后、放疗后6个月、放疗后7个月的MRI图像见图4~图11。
林辉:患者影像学病灶增大, 是复发还是放射性坏死?如果是复发, 下一步治疗手段?
黄飚:从再程放疗后7个月的MRI增强图像看, 病灶是大片花环样边缘强化, 水肿明显, 形态不规则, 有尖角征, 和术后1个月的MRI只是术区的环形强化有明显不同。WHO Ⅱ 级的胶质瘤一般强化不明显, 同时考虑病灶出现的时间是放射性坏死发生的高峰期, 综合以上考虑放射性坏死可能性大。但是对于胶质瘤来说诊断为放射性坏死也不能排除病灶的边缘有肿瘤残留, 因为胶质瘤大部分会复发, 所以虽然放射性坏死可能性大, 也不能除外有肿瘤的可能, 建议定期复查。
李伟雄:考虑放射性脑病可能性大。基于以下三点:①该患者的基因属于预后较好的患者, 既往文献报道一般再程放疗的中位进展时间约1年, 该患者目前仅7个月病灶明显进展。②该患者病灶进展出现的时间符合放射性脑病的高发时间。③该患者再程放疗期间使用了替莫唑胺化疗, 文献报道同期联合替莫唑胺可能增加放射性脑病的发生率。
旁述:Combs等[12]2005年发表在《J Clin Oncol》的文献显示WHOⅡ 级胶质瘤再程放疗后的中位无进展生存期约12个月。
郑登云:从影像学来看患者放射性脑病可能性大, 但是不能排除有肿瘤进展, 可行贝伐单抗治疗, 因为贝伐单抗可以治疗放射性脑坏死, 同时对于复发胶质瘤可能也有获益。
杨衿记(肿瘤学教授):回顾患者第一次放疗, 按照指南可以选择放疗或者观察, 虽然总生存期是一样的, 但是如果患者接受放疗, 出现了放射性脑病可能会对患者的生存质量有影响, 目前出现放射性坏死的可能性大, 可以行小剂量的贝伐单抗治疗, 以减轻水肿。
郭文龙:从影像学看考虑放射性坏死可能性大, 目前对于鼻咽癌放疗后颞叶放射性坏死手术的经验比较多, 对于胶质瘤放疗后脑坏死的手术经验不多, 建议先内科治疗, 如效果不佳再考虑手术治疗。
李伟雄:再回顾该病例, 如果当年有分子分型检查, 明确患者预后较好, 第一次术后可能不选择术后放疗, 而选择随访观察。从第二次术后病理提示患者IDH1基因有突变, 根据文献报道复发后IDH基因状态变化较少, 第一次可能也是IDH基因有突变, 所以分子分型对临床决策的重要性就体现在这。
吴一龙:我总结一下。该病例治疗比较成功, 随访至今总生存时间已达到9年。目前虽然有分子分型指导各种治疗手段的选择, 但是我们需要注意所有的治疗手段都是一把双刃剑, 有疗效, 同时也可能产生毒副反应。对于指南上建议可以选择观察或者治疗的情况, 我们应该首先选择简单的方法, 比如随访观察, 其余的治疗手段可以之后使用。对于本病例, 第一次手术后指南建议可以观察或者放疗, 虽然我们选择放疗是考虑该患者无法进行规律随访, 但是我们也可以选择最简单的观察。当我们临床经验积累到一定程度就会理解, 越简单的治疗手段往往越好(疗效与不良反应综合考虑), 因为一种治疗手段带来疗效的同时也会产生不良反应, 即有好处也可能有坏处, 当疗效不明显而出现不良反应时, 反而不能给患者带来获益。对于再程放疗需要慎重, 因为再程放疗导致的毒副反应处理很棘手。我们临床医师治疗应该遵守指南, 但仅按照指南来进行临床决策是不够的, 要紧跟学术前沿, 譬如:PD1在胶质瘤治疗中的运用, 最新的治疗方案只有等到所有的临床试验完成并有结果后才写入指南。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|