作者简介:欧阳暂(1992-),男,四川绵阳人,硕士研究生,从事胃肠道肿瘤的诊断及治疗。
目的 研究精氨酸强化的免疫营养支持对胃癌患者术后免疫功能以及感染并发症发生率的影响。方法 检索PubMed、Cochrane 图书馆、EMBASE、Web of Science、中国知网、万方、维普等数据库,采集所有研究精氨酸强化的免疫营养应用于胃癌患者术后营养支持的临床随机对照试验,发表年限为1996年至2017年1月。并通过互联网检索相关学位论文、会议摘要等灰色文献。采纳Cochrane协作网提供的偏倚风险评估量表联合修改后的Jadad量表进行文献质量评价,由两位评价者独立评价纳入的文献,并使用RevMan 5.2软件进行Meta分析。结果 共检索到241篇文献,最终纳入13篇,样本量为947例。Meta分析结果:围手术期应用精氨酸强化的免疫营养可降低胃癌患者术后感染率(比值比0.42,95%可信区间0.21~0.86,P=0.02,差异有统计学意义)。同时可增强细胞免疫功能,CD3+T细胞亚群均数差4.95,95%可信区间 3.82~6.08,P<0.000 01;CD4+T细胞亚群均数差5.38,95%可信区间3.02~7.74,P<0.000 01;CD8+T细胞亚群均数差-1.46,95%可信区间-2.53~-0.39,P=0.008;CD4+/CD8+ 比值均数差 0.26,95%可信区间0.02~0.50,P=0.03;且试验组反映体液免疫功能的各指标(IgA、IgG、IgM等)较对照组明显升高,组间差异均有统计学意义。结论 精氨酸强化的免疫营养可增强胃癌患者术后免疫功能,减少术后感染性并发症的发生。
Objective To explore the effects of arginine-enhanced immunonutritional support on postoperative immune function and incidence of infected complications in patients with gastric cancer.MethodsPubMed, Cochrane Library, EMBASE, Web of Science, CNKI, Wanfang database, VIP database and other databases were retrieved to collect all the randomized controlled trials(RCTs) published from 1996 to January 2017, of which researched arginine-enhanced immunonutrition applied in patients with gastric cancer who need postoperative nutritional support. And relevant theses, meeting abstracts and other gray literature publications were searched through the internet. We conducted the quality assessment of included literatures with Cochrane Library’s risk of bias table and the modified Jadad Scale by two independent reviewers. The RevMan 5.2 software was used for meta-analysis on homogeneous studies.Results A total of 241 literatures were retrieved, however, only 13 articles were included in this study, involving 947 cases. Meta analysis results illustrated that perioperative using of arginine-enhanced immune nutrition could reduce the rate of postoperative infection in patients with gastric cancer [OR(odds ratio)=0.42,95%CI (confidence interval)0.21~0.86,P=0.02], and the difference was statistically significant. Cellular immune function was enhanced simultaneously. CD3 + T cell subsets[MD(mean difference) 4.95,95%CI 3.82~6.08,P<0.000 01], CD4+T cell subsets (MD 5.38,95%CI 3.02~7.74,P<0.000 01), CD8+ T cell subsets (MD -1.46,95%CI -2.53~-0.39,P=0.008)、CD4+/CD8+(MD 0.26,95%CI 0.02~0.50,P=0.03), and the indicators reflect humoral immune function (IgA, IgG, IgM, etc.) in the experimental group were significantly higher than those in the control group, all the differences between the two groups were statistically significant.ConclusionArginine-enhanced immunonutrition can enhance postoperative immune function in patients with gastric cancer and reduce the incidence of postoperative infectious complications.
据世界卫生组织2012年在全球范围内实施的肿瘤流行病学调查统计结果, 男女性胃癌死亡率均高居所有恶性肿瘤第三位, 发病率均为顺位第五位, 而中国作为胃癌最高发地区, 胃癌发病率的全球比重高达44.50%, 死亡率全球比重高达41.28%[1]。同期全国肿瘤研究防治办公室等权威机构联合发布的国内相关数据显示全国范围内胃癌总发病率居所有恶性肿瘤发病率第二位, 总死亡率居第三位[2]。胃癌患者在围手术期同时受到肿瘤消耗、免疫抑制及手术打击等多种因素的负面影响, 极大地增加了患者术后发生感染的风险, 多宗研究均报道胃癌术后最常见并发症为感染并发症[3, 4, 5], 而感染性并发症的出现势必造成患者住院时间延长并极大增加个人及社会经济负担。
从上世纪80年代开始, 国内外多个研究机构就以改善住院患者免疫功能与减少术后感染并发症发生为目的, 以手术患者为中心研究出了许多不同的营养素及营养策略, 而精氨酸及精氨酸强化型营养制剂是这些研究的核心药理营养素[6]。这些饮食配方同时还含有Ω -3脂肪酸、RNA、谷氨酰胺等其他药理营养素, 精氨酸强化的营养制剂也渐渐演化为商品型营养制剂, 例如Stresson(NUTRICIA, Inc), Impact(Nestle, Inc)等, 被广泛应用于不同人群, 旨在于“ 加强免疫功能” 。虽然多宗试验[7, 8, 9]证实了精氨酸对免疫系统具有正性调节作用, 然而这些营养素单独应用于不同人群时产生的作用及副作用的情况目前尚不明确, 且国内外多个机构实施的临床试验受限于试验设计及样本量不足等因素, 不能很好地阐明精氨酸强化的营养制剂的临床效果。故本研究旨在运用Meta分析的方法, 收集国内外对胃癌患者在围手术期应用精氨酸强化免疫营养治疗相关研究, 探讨精氨酸强化的免疫营养对胃癌患者术后免疫功能的影响, 以期为胃癌患者术后是否需要行精氨酸强化的免疫营养治疗提供证据。
(1)研究类型:随机对照试验(randomized controlled trial, RCT), 以治疗为目的, 比较精氨酸强化免疫营养支持和标准营养支持对胃癌患者术后免疫功能影响的研究, 无论是否含其他药理营养素, 不限制盲法的使用; (2)研究对象:经病理学确诊并行择期手术的胃癌患者; (3)干预实施:试验组于围手术期经肠内或者肠外途径予以精氨酸强化免疫营养支持, 无论是否含其他药理营养素, 具体方案不限, 对照组予以等氮等热量标准饮食; (4)主要观察指标:术后感染率及T细胞亚群, 次要观察指标为:体液免疫相关的指标如免疫球蛋白IgG、IgM、IgA、IL-2、IL-6、TNF-α ; (5)排除标准:试验组未添加精氨酸的研究、针对胃肠道肿瘤的研究未提出胃癌组人数者、观察指标与本研究不符、非RCT、Jadad评分小于4分的研究、重复发表的研究。
检索PubMed、Cochrane 图书馆、EMBASE、Web of Science、中国知网、万方、维普等数据库所有公开发表的相关中文、英文文献, 发表年限为1996年至2017年1月。并通过互联网检索相关学位论文、会议摘要等灰色文献。通过主题词结合自由词的检索策略检索:胃癌、上消化道恶性肿瘤、胃恶性肿瘤、精氨酸、免疫营养、营养支持、临床、随机、对照、arginine、gastric、stomach、neoplasm、carcinoma、tumor、randomized、clinical trial、immunonutrition、immune nutrition、immunoenhanced nutrition、immune-enhancing nutrition、arginine-supplemented immunonutrition。通过阅读标题及摘要初筛可能相关文献, 所得文献仔细阅读全文, 根据前述纳入及排除标准决定是否纳入本研究。由两位评价者独立地根据前述纳入及排除标准对文献的研究设计、研究对象、方案实施及研究结果进行评价, 采集相关信息。数据采集工作由两位评价者独立进行, 如遇分歧则咨询采纳第三方意见。
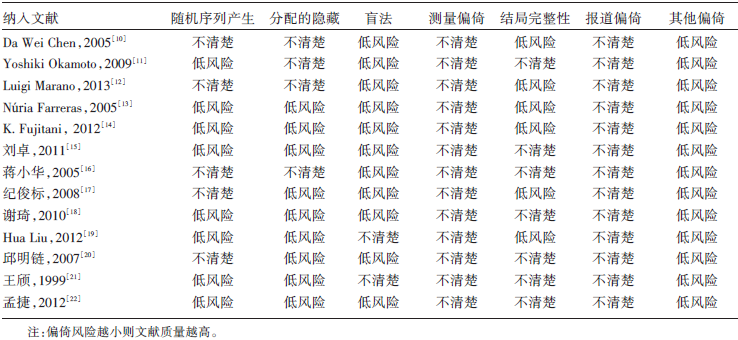
根据修改后的Jadad量表评价纳入文献, 具体评价标准包括:(1)随机序列的产生; (2)是否使用隐藏随机化过程; (3)盲法使用是否恰当; (4)是否描述撤出与退出的理由。随机对照试验质量依据得分而定, 得分1~3分的文献视为低质量, 予以排除。得分4~7分的文献视为高质量文献, 予以纳入。所有纳入文献再根据Cochrane协作网提供的偏倚风险评估量表进行第二次文献质量评价。如遇分歧则咨询采纳第三方意见。
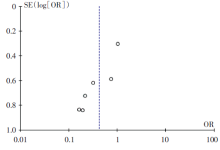
运用RevMan 5.2软件进行统计学分析, 以95%为可信区间(confidence interval, CI)。术后感染率的描述采用比值比(odds ratio, OR), 试验室检验所得连续性变量资料的描述采用(均数± 标准差)方式。纳入的各项研究均通过Q检验及I2检验进行异质性检验, 以P> 0.5、I2< 50%为同质性良好的标准, 反之认为各项研究存在明显异质性。同质性良好的各项研究采用固定效应模型进行后续分析。具有异质性的各项研究采用随机效应模型进行后续分析, 并进行异质性分析。最后绘制漏斗图进行发表偏倚的检测。
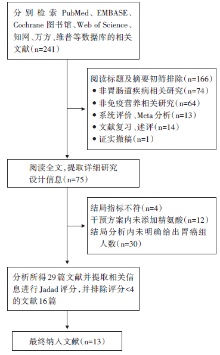
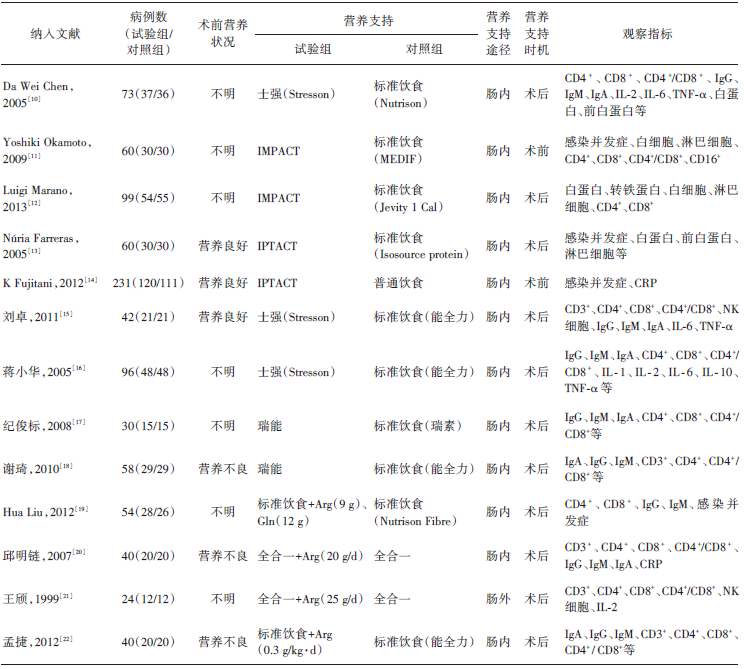
初次检索共得到文献241篇(PubMed 25篇, Cochrane 图书馆 44篇, EMBASE 25篇, Web of Science 21篇, 中国知网 47篇, 万方 60篇, 维普 19篇), 通过阅读标题、摘要及详细阅读全文排除不符合标准的文献, 最后纳入13篇文献, 纳入研究对象共947例。文献筛选流程见图1, 纳入研究的基本情况见表1。
所纳入研究中, 使用精氨酸配方制剂, 即混合使用精氨酸的研究共9项[10, 11, 12, 13, 14, 15, 16, 17, 18], 单独添加精氨酸的有4项[19, 20, 21, 22], 术前患者营养状况良好的有3项[13, 14, 15], 营养状况不良的有3项[18, 20, 22], 患者营养状况不明的有7项[10, 11, 12, 16, 17, 19, 21]。纳入研究均运用Cochrane 偏倚风险量表进行质量评价, 评价结果见表2。
| 表1 纳入文献的基本特征 |
| 表2 纳入文献的质量情况 |
2.2.1 感染性并发症
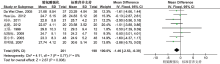
共6项研究报道了精氨酸强化免疫营养对胃癌患者术后感染性并发症发生率的影响, n=572, 各项研究间存在轻度异质性(P< 0.06, I2=52%), 采用随机效应模型进行Meta分析, 结果显示: OR 0.42, 95%CI 0.21~0.86, P=0.02, 差异有统计学意义。Meta分析结果见图2。
2.2.2 细胞免疫功能
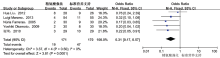
共5项研究报道了精氨酸强化免疫营养对胃癌患者术后CD3+T细胞亚群比例的影响, n=213, 各项研究间同质性良好(P=0.21, I2=32%), 采用固定效应模型进行Meta分析, 结果显示:均数差(mean difference, MD)=4.95, 95%CI 3.82~6.08, P< 0.000 01, 差异有统计学意义。Meta分析结果见图3。
共9项研究报道了精氨酸强化免疫营养对胃癌患者术后CD4+T细胞亚群比例的影响, n=461, 各项研究间异质性明显(P< 0.000 01, I2=83%), 采用随机效应模型进行Meta分析, 结果显示:MD 5.38, 95%CI 3.02~7.74, P< 0.000 01, 差异有统计学意义。Meta分析结果见图4。
共8项研究报道了精氨酸强化免疫营养对胃癌患者术后CD8+T细胞亚群水平的影响, n=399, 各项研究间同质性良好(P=0.77, I2=0%), 采用固定效应模型进行Meta分析, 结果显示:MD -1.46, 95%CI -2.53~-0.39, P=0.008, 差异有统计学意义。Meta分析结果见图5。
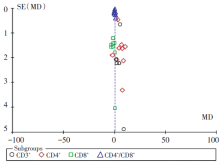
共9项研究报道了精氨酸强化免疫营养对胃癌患者术后CD4+/CD8+比值的影响, n=463, 各项研究间异质性明显(P< 0.000 01, I2=85%), 采用随机效应模型进行Meta分析, 结果显示:MD 0.26, 95%CI 0.02~0.50, P=0.03, 差异有统计学意义。Meta分析结果见图6。
2.2.3 体液免疫功能
共7项研究报道了精氨酸强化免疫营养对胃癌患者术后IgA水平的影响, n=379, 各项研究间异质性明显(P< 0.000 01, I2=88%), 采用随机效应模型进行Meta分析, 结果显示:MD 0.25, 95%CI 0.01~0.48, P=0.04, 差异有统计学意义。共8项研究报道了精氨酸强化免疫营养对胃癌患者术后IgG水平的影响, n=433, 各项研究间异质性明显(P< 0.000 01, I2=84%), 采用随机效应模型进行Meta分析, 结果显示:MD 1.29, 95%CI 0.33~2.25, P=0.009, 差异有统计学意义。共8项研究报道了精氨酸强化免疫营养对胃癌患者术后IgM水平的影响, n=433, 各项研究间异质性明显(P< 0.000 01, I2=84%), 采用随机效应模型进行Meta分析, 结果显示: MD 0.22, 95%CI 0.06~0.38, P=0.007, 差异有统计学意义。Meta分析结果见图7。
共3项研究报道了精氨酸强化免疫营养对胃癌患者术后IL-2水平的影响, n=193, 各项研究间同质性良好(P=0.76, I2=0%), 采用固定效应模型进行Meta分析, 结果显示:标准化均数差(standard mean difference, SMD)0.77, 95%CI 0.48~1.07, P< 0.000 1, 差异有统计学意义; 共3项研究报道了精氨酸强化免疫营养对胃癌患者术后IL-6水平的影响, n=211, 各项研究间同质性良好(P=0.67, I2=0%), 采用固定效应模型进行Meta分析, 结果显示:SMD 0.69, 95%CI -0.97~-0.41, P< 0.000 1, 差异有统计学意义。Meta分析结果见图8。
共3项研究报道了精氨酸强化免疫营养对胃癌患者术后TNF-α 水平的影响, n=211, 各项研究间同质性良好(P=0.60, I2=0%), 采用固定效应模型进行Meta分析, 结果显示:MD -108.78, 95%CI -139.08~-78.48, P< 0.000 1, 差异有统计学意义。Meta分析结果见图9。
为保证结论的稳定性, 对主要观察指标感染率及细胞免疫功能进行敏感性分析。删除样本量过大(n> 100)的研究[14], 以及样本量过小(n< 40)的研究[17, 21]。并对异质性显著的CD4+T细胞组根据精氨酸的添加方式进行亚组分析。敏感分析结果提示精氨酸强化的免疫营养可降低胃癌患者术后感染率, 试验组感染性并发症发生率明显低于对照组(OR 0.31, 95%CI 0.17~0.57, P=0.000 1), 结论稳定性良好, Meta分析结果见图10。细胞免疫功能方面, 精氨酸强化的免疫营养可起到正性调节作用, 提高术后细胞免疫功能, 试验组CD3+、CD4+T细胞亚群值均高于对照组, CD8+T细胞亚群低于对照组, 结论稳定性良好。且对CD4+T细胞组进行亚组分析后结果显示, 单独使用精氨酸的各研究[19, 20, 22]间同质性良好, MD 5.21, 95%CI 3.15~7.27, P< 0.000 01, 差异有统计学意义, 混合使用精氨酸的各研究间异质性明显, 但Meta分析结果与单独使用亚组一致, MD 5.51, 95%CI 3.21~7.82, P< 0.000 01, 差异有统计学意义。Meta分析结果见图11和图12。
精氨酸作为条件必需氨基酸, 在人体的多个新陈代谢过程中必不可少:(1)参与尿素循环, 转运体内的含氮废物; (2)作为中间产物参与体内大多数种类蛋白质的合成; (3)精氨酸是多胺、羟脯氨酸合成的前体, 后两者在结缔组织的修复过程中起着主要作用; (4)精氨酸是一氧化氮(nitric oxide, NO)合成的前体, 后者是主要的舒张血管因子, 并参与细胞内信号转导过程、刺激自然杀伤(natural killer, NK)细胞活化、抑制肿瘤生长; (5)促进外周血中淋巴细胞的数量的增加, 并在特定情况下对T淋巴细胞为主的细胞免疫起到正性调节作用[23, 24, 25, 26, 27, 28]。创伤伤员、手术患者、肿瘤患者体内精氨酸水平明显低于正常值[29, 30], 其发生机制目前尚不明确, 但有学者指出这可能是由于循环和淋巴系统中的未成熟骨髓原始细胞表达Ⅰ 型精氨酸酶, 大量分解精氨酸以产生鸟氨酸[25]。因精氨酸被大量消耗导致获得性免疫系统抑制, 特别是细胞免疫功能的抑制, 极大增加了胃癌患者术后感染的风险。
本研究运用Meta分析的方法, 对国内外13项随机对照临床试验进行系统性分析, 研究精氨酸强化免疫营养对胃癌患者术后免疫功能的影响。在CD3+、CD8+T细胞亚组内各研究间同质性良好, 结果显示运用精氨酸的试验组术后CD3+T细胞值明显高于对照组, CD8+T细胞明显低于对照组。鉴于CD4+T细胞亚组内各研究间异质性较大, 遂根据试验组所选择的精氨酸制剂不同进行亚组分析, 结果显示运用精氨酸的试验组术后CD4+T细胞值明显高于对照组, 且合并结果后单独使用精氨酸的各研究间异质性明显降低, 而混合使用精氨酸的各研究间异质性仍显著, 提示试验方案中精氨酸制剂的不同是各研究间异质性的主要来源。上述结果提示围手术期补充精氨酸可明显增加患者体内CD3+、CD4+T细胞亚群数量, 正性调节胃癌患者的术后细胞免疫功能, 并减少具有负性调节作用的CD8+T细胞亚群数量。在术后感染率方面, 合并相关各研究后结果显示精氨酸可明显降低胃癌患者术后感染并发症的发生率。上述结论均经敏感性分析处理后证实稳定性良好。
同时, 共8项研究[10, 15, 16, 17, 18, 19, 20, 22]报道了精氨酸强化免疫营养对胃癌患者术后抗体水平的影响, Meta分析结果可见试验组免疫球蛋白IgG、IgM、IgA明显高于对照组。共4项研究[10, 15, 16, 21]报道了精氨酸强化免疫营养对胃癌患者术后IL-2、IL-6水平的影响, Meta分析结果提示试验组IL-2水平明显高于对照组, 而IL-6低于对照组。共3项研究[10, 15, 16]报道了精氨酸强化免疫营养对胃癌患者术后TNF-α 水平的影响, Meta分析结果提示试验组TNF-α 水平明显低于对照组。由于精氨酸可对外周血中淋巴细胞的释放起到促进作用, 故试验组较对照组免疫球蛋白的水平明显高, 反映出胃癌患者术后体液免疫功能的增强。IL-2是一种重要的免疫调节因子, 可促进T细胞、B细胞、NK细胞等多种细胞增殖, 且在体内主要由活化的T淋巴细胞亚群产生, 试验组较对照组IL-2水平明显升高可从侧面反映胃癌患者体内细胞免疫功能得到增强[31]。而作为炎症反应标志物的IL-6、TNF-α , 二者水平较对照组降低提示使用精氨酸强化的免疫营养可减轻胃癌患者术后全身炎性反应[32, 33]。
在本研究中, 各纳入文献在试验设计的诸多方面存在差异。如补充精氨酸的方式, 9项研究[10, 11, 12, 13, 14, 15, 16, 17, 18]均采用富含精氨酸的混合营养制剂, 4项研究[19, 20, 21, 22]单独添加精氨酸, 未使用其他药理营养素。如患者术前营养状况, 3项研究[13, 14, 15]陈述均纳入术前营养状态良好的患者, 3项研究[18, 20, 22]陈述均纳入术前营养状态不良的患者, 7项研究[10, 11, 12, 16, 17, 19, 21]未陈述纳入患者术前营养状态。其他方面如盲法的实施、手术方式, 肿瘤分期, 营养支持途径不同也是产生临床异质性的可能因素。这些确实存在的异质性可能影响数据合并的检验效能及结论的稳定性。虽本研究尽可能全面地检索了国内外主要数据库, 以及包括灰色文献在内的关于胃癌患者术后使用免疫营养的RCT, 但限于可纳入研究数目不足, 未能对所有可能导致异质性的因素进行亚组分析, 有待后续纳入更多更新的RCT后完善分析。
精氨酸缺乏作为引起胃癌患者术后免疫功能抑制的中心环节, 应得到临床及科研工作者更多重视, 现有的研究限于试验设计缺陷、样本量不足等因素, 不能充分证明在围手术期对胃癌患者应用精氨酸强化的免疫营养的疗效。本研究通过Meta分析所得到的结论是精氨酸强化的免疫营养可增强胃癌患者术后的免疫功能, 减少术后感染并发症发生率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|