作者简介:吕泽坚(1986-),男,广东汕头人,医学硕士,从事胃肠恶性肿瘤研究。
目的 探讨XELOX方案联合放疗的新辅助治疗在局部进展期中低位直肠癌的不良反应及临床疗效。方法 回顾性分析2014年6月至2016年12月广东省人民医院普通外科胃肠专业组收治的符合纳入排除标准的75例局部进展期中低位直肠癌患者的资料,患者接受XELOX 3周方案新辅助化疗3疗程,并联合新辅助放疗,评价患者的不良反应及临床疗效。结果 3例患者未完成新辅助治疗,72例完成新辅助治疗;71例行根治性全直肠系膜切除术,1例因肿瘤广泛转移无法手术;总共发生不良反应173例次,Ⅲ度以上不良反应20例次。肿瘤标志物有下降趋势。病理完全缓解16例(22.2%),部分缓解49例(68.1%),疾病稳定6例(8.3%),疾病进展1例(1.4%);有效率达89.0%。结论 XELOX方案联合放疗的新辅助治疗在局部进展期中低位直肠癌患者是安全有效的。
Objective To explore the toxicity and efficacy of neoadjuvant chemoradiotherapy with XELOX on the treatment for patients of advanced mid-low rectal cancer.MethodsFrom June 2014 to December 2016, 75 patients with advanced mid-low rectal cancer were treated in the gastroenterology department of Guangdong General Hospital,whose data were retraspective analysed. The patients received neoadjuvant chemotherapy of XELOX every 3 weeks for 3 cycles combined with neoadjuvant radiotherapy.Results2 cases drop-out and 1 case quited chemoradiotherapy because of serious adverse events. 72 patients received complete chemoradiotherapy, of which 71 received TME operation and 1 occured metastases. A total of 173 times of adverse reaction occured, of which 20 were ≥ grade 3. Tumor markers in these patients had a downward trend. After neoadjuvant therapy, patlogy complete response happened in 16 cases (22.2%), partial response in 49 cases (68.1%), stable disease in 6 cases (8.3%), progression in 1 cases (1.4%), the response rate was 89.0%.ConclusionPreoperative chemoradiotherapy with XELOX for patients with advanced mid-low rectal cancer is safe and effective.
直肠癌作为消化道最常见的恶性肿瘤之一[1], 近年来其发病率及死亡率逐年上升。手术治疗是其首选治疗方案, 且手术切除是早期直肠癌患者获得根治性治疗的唯一治疗手段。但进展期直肠癌盆腔局部复发率较高, T3N0M0 患者术后复发率 15%~35%, T3~4N1~2M0患者甚至可达 45%~65%, 术前放疗能明显改善局部控制率, 使局部复发的相对风险降低 50%~70%[2]。因此, 对进展期直肠癌患者, 目前强调以手术为主的包括放化疗在内的综合治疗, 新辅助治疗就是其中的一种治疗手段。但目前新辅助治疗的方案尚未统一, 而且不同治疗方案的临床疗效也不尽相同。卡培他滨或5-氟尿嘧啶联合放疗是局部进展期直肠癌的推荐方案, 但仍有部分患者在治疗过程中出现进展, 其治疗强度存在不足。
目前普遍观点认为对于局部进展期直肠癌患者进行术前XELOX方案加放疗的方法仅增加放化疗毒副反应而未增加生存获益, 但仍存在争议, 且目前国内关于这方面的研究相对较少。本研究利用XELOX 3周方案联合同期放疗应用于75例局部进展期直肠癌患者, 进一步探讨该方案的不良反应和有效性。
回顾2014年6月至2016年12月广东省人民医院普通外科胃肠专业组收治的、经体格检查和影像学检查等综合判断为局部进展期中低位直肠癌患者的资料。入组标准:①经肠镜检查及病理活检确诊为直肠癌; ②经CT、MRI或超声肠镜检查, 肿瘤临床分期为T3~4N0M0或T1~4N1~2M0; ③肿瘤距离肛门< 10 cm。排除标准:①肿瘤远处转移; ②一般状况差, 难以耐受放化疗; ③合并肠梗阻、穿孔、出血等需急诊手术处理的并发症。入组患者75例。男性46例, 女性29例; 年龄26~71岁, 平均51.1岁; 术前影像学评估肿瘤TNM分期:Ⅱ 期19例(25.3%), Ⅲ 期56例(74.7%)。肿瘤分化程度:高分化腺癌3例, 中分化腺癌63例, 低分化腺癌9例。所有患者接受新辅助治疗前均签署知情同意书。
所有患者均接受XELOX 3周方案新辅助化疗3疗程, 具体方案为奥沙利铂130 mg/m2, d1; 卡培他滨 1 000 mg/m2, Bid, d1~d14; 放疗与第2个疗程化疗同步, 采用全盆腔+肿瘤局部放疗方案, 盆腔剂量45 Gy/25次/5周, 肿瘤局部剂量5.4 Gy/3次/3天, 总剂量50.4 Gy。同时予止呕、护胃、升白细胞等对症支持治疗。当患者出现Ⅲ 度以上不良反应时, 化疗药物剂量减少25%。新辅助治疗结束6~8周后行根治性全直肠系膜切除术。
治疗前和手术前对患者进行体格检查(主要是直肠指检), 对比治疗前后肿瘤大小和肿瘤移动度情况; 行CT、MRI或超声肠镜, 根据影像学变化(肿瘤大小、淋巴结累及情况及远处转移情况)评估肿瘤TNM分期; 抽血化验观察肿瘤标志物CEA、CA19-9水平变化情况; 并分析评价患者放化疗的不良反应如骨髓抑制、恶心呕吐、腹泻、肝肾功能损害、手足综合征、放射性皮炎、外周神经毒性等。
75例患者中, 3例患者未完成新辅助治疗, 72例患者完成3个疗程的化疗和同期放疗。71例在新辅助治疗结束6~8周后接受根治性全直肠系膜切除术, 1例因肿瘤广泛转移无法手术。
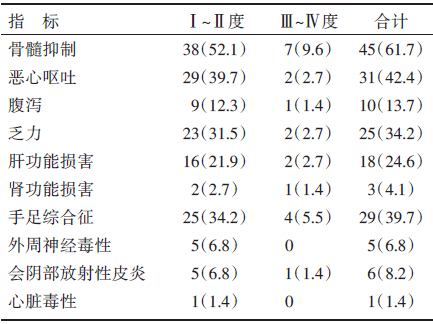
新辅助治疗过程中, 全组患者的不良反应情况见表1。总共发生不良反应173例次, Ⅲ 度以上不良反应20例次。最常见的不良反应为骨髓抑制, 主要表现为白细胞和粒细胞减少, 其次为恶心呕吐、乏力和手足综合征, 肝肾功能损害、腹泻、外周神经毒性和会阴部放射性皮炎相对较少。1例患者因Ⅳ 度骨髓抑制、粒细胞缺乏引起的败血症退出治疗。无新辅助放化疗相关的死亡并发症。出现Ⅲ ~Ⅳ 度不良反应的患者, 予减少化疗药物剂量25%、延长化疗间隔(延迟不超过7天)及升白细胞、护胃止呕、止泻、护肝、止痛、营养神经等对症处理后缓解。
| 表1 接受新辅助治疗患者的不良反应情况n(%) |
术前抽血化验提示新辅助治疗前CEA水平高于正常值患者34例(46.6%), 经新辅助治疗后32例患者较前下降, 其中19例下降至正常水平; 但有5例患者较前升高, 其中2例患者由治疗前的正常水平上升为高于正常值。新辅助治疗前CA19-9水平高于正常值28例(38.4%), 经新辅助治疗后23例较前下降, 其中11例下降至正常水平; 但有7例较前升高, 其中2例由治疗前的正常水平上升为高于正常值。
结合体格检查及影像学变化、术中所见、术后病理结果综合判断, 73例局部进展期中低位直肠癌患者经新辅助治疗后, 病理完全缓解(pathologic complete response, pCR)16例(22.2%), PR 49例(68.1%), SD 6例(8.3%), PD 1例(1.4%); RR达89.0%。
新辅助治疗可不同程度地减轻进展期直肠癌患者的肿瘤负荷, 使肿瘤缩小, 从而达到减少手术创伤、提高手术根治率及降低术后局部复发率的目的, 因此, 近年来越来越受到临床医生的重视。
新辅助治疗的目的主要是缩小原发肿瘤, 使不可切除的病灶变成可切除。对于局部进展期中低位直肠癌患者, 与术后辅助治疗相比, 新辅助治疗具有以下优势:①缩小病灶, 使部分无法根治的肿瘤降期达到手术根治; ②降低肿瘤细胞活力, 减少术中癌细胞医源性播散; ③术前肿瘤的血管和淋巴管完整, 可向肿瘤输送更多化疗药物, 提高局部药物浓度, 具有良好且高限度的杀伤肿瘤细胞的作用; ④是体内最好的药物敏感性试验, 指导术后治疗方案的选择[5]; ⑤控制和消灭临床或亚临床的微小转移灶, 减少术后复发、转移; ⑥术前患者体质较好, 较少发生急性毒性反应, 对新辅助治疗的耐受性和依从性均较好[6] 。另有研究报道, 根据新辅助放化疗的结果, 可以筛选出那些转移风险相对较小的恶性肿瘤[7]。
本研究中, 新辅助化疗方案中加入奥沙利铂, 不良反应并未明显增加, 患者耐受性良好。1例患者因Ⅳ 度骨髓抑制、粒细胞缺乏引起的败血症退出治疗, 无治疗相关的死亡, 且出现Ⅲ ~Ⅳ 度不良反应的患者经对症处理后缓解。Turner等[8]发现新辅助化疗并不增加术后并发症的发生。德国AIO研究对比手术前后辅助治疗临床疗效的临床随机对照试验结果表明, 术前放化疗组的不良反应发生率明显低于术后放化疗组(27% vs. 40%), 长期的Ⅲ ~Ⅳ 度毒性也显著降低(14% vs. 24%)[6]。
本研究关于直肠癌新辅助治疗的临床疗效与文献报道的结果相当, 且经过新辅助放化疗, 患者的肿瘤标志物有下降趋势。Saigusa等[9] 的研究发现, 新辅助放化疗使 128 例局部进展期的直肠癌患者pCR 高达 25%。降低局部复发率是直肠癌新辅助放化疗值得肯定的效果之一。1997 年瑞典一项大规模随机对照试验第一次证明了术前放疗联合手术治疗有助于降低 5 年原位复发率且提高总生存率[10], 随后多项研究也证明了这一结论[6, 11, 12, 13]。
但新辅助治疗方案中是否增加奥沙利铂的使用仍存在较大的争议。随机对照的STAR-01研究[14]表明, 5-氟脲嘧啶增加奥沙利铂组的毒性反应明显增高, 为24% vs. 8%; 同时NSABP-R04研究[15]也显示奥沙利铂的使用增加了Ⅲ ~Ⅳ 度毒副反应。同时以上临床试验结果显示增加奥沙利铂未能带来明显的生存获益。多中心研究ACCORD12/0405 PRODIGE[16]显示, 增加了奥沙利铂以后完全缓解率及保肛率稍有提高, 但奥沙利铂带来化疗相关的毒性反应相应明显增加(25% vs. 11%)。随后, ACCORD12/0405 的随访结果显示[17], 增加使用奥沙利铂并未带来明显生存相关获益, 不推荐术前新辅助治疗增加奥沙利铂的使用。2014年ASCO大会报道的CAO/ARO/AIO-04研究[18]显示, 经过50多个月随访, 加用奥沙利铂组的3年无病生存率明显升高(75.9% vs. 71.2%), 证实奥沙利铂能带来生存获益的报道, 同时该研究也同样证实使用奥沙利铂可带来较多的Ⅲ ~Ⅳ 度毒性反应。综上, 直肠癌术前新辅助治疗加入奥沙利铂是明显获益不大的。但是笔者认为, 加入奥沙利铂是为了强化卡培他滨对于肿瘤的控制作用, 以上研究仅在术前短期治疗中加入大剂量的奥沙利铂, 对于局部的控制以及远期的预后难以有效地改善。此外, 这些研究仅对淋巴结阳性或原发灶T3/T4患者进行了相关讨论, 而对于淋巴结阳性或原发灶T3/T4合并可切除或潜在可切除肝、肺转移的患者, 术前治疗加入奥沙利铂仍有其应用价值。2015年Zheng等[19]的Meta分析显示, 直肠癌新辅助放化疗增加奥沙利铂, 增加了化疗相关的毒副反应同时提高了pCR率、降低术前转移率、局部复发率并延长无病生存时间, 表明加入奥沙利铂能给患者带来生存获益。本中心局部进展期直肠癌患者术前治疗加入奥沙利铂, RR达89.0%, 不良反应未见明显增加。因此, 术前新辅助治疗是否加入奥沙利铂, 如何加入合适剂量的奥沙利铂, 还需进一步临床研究证实。
但新辅助治疗也存在许多问题:①新辅助治疗的不良作用如肝肾功能损害、骨髓抑制等, 可能增加手术并发症发生率和死亡率; ②目前尚无法预测肿瘤对新辅助治疗的敏感性, 对部分不敏感的患者, 新辅助治疗不但无法使肿瘤降期, 反而会延误最佳手术时机; ③化疗后局部炎症反应或肿瘤坏死等因素导致肿瘤边界不清, 可能增加手术难度。本研究中有1例患者在治疗过程中出现肿瘤远处转移, 病情进展, 这就需要我们在新辅助治疗过程中密切随访, 进行体格检查和影像学检查, 密切观察患者病情变化, 采取必要的干预措施。
本研究中新辅助治疗化疗方案加入了奥沙利铂, 与5-氟脲嘧啶单药方案对比, 不良反应并未明显增加, 患者耐受良好; 但短期疗效无明显优势, 是否在总生存期和无病生存期等长期疗效方面具有优势, 还有待长期随访观察。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|