作者简介:王华军(1979-),女,河南沈丘人,主管护师,硕士,研究方向为内科护理及护理管理。
目的 通过建立大鼠压疮缺血再灌注性损伤缺血处理模型,比较缺血联合处理方法对大鼠皮肤及皮下组织的保护作用,为临床判断压疮损伤的程度及压疮干预效果提供理论依据。方法 将60只SD大鼠随机分为对照组、缺血再灌注组、缺血联合处理组,每组20只,建立大鼠压疮缺血再灌注性损伤处理模型,通过肉眼观察受压程度,检测血清氧自由基的水平,以判断压疮缺血再灌注损伤程度。结果 缺血再灌注组、缺血联合处理组大鼠出现Ⅰ期压疮的发生率为100%;缺血联合处理组血清一氧化氮[(40.2±1.3) μmol/L]、丙二醛[(5.3±0.4) nmol/mL]含量均高于对照组(P<0.005),明显低于缺血再灌注组,超氧化物歧化酶活性[(122.0±7.3)U/mL]低于对照组,明显高于缺血再灌注组(P<0.001)。结论 缺血联合处理对压疮缺血再灌性损伤具有保护作用,该联合处理方法在降低丙二醛和一氧化氮水平、增加超氧化物歧化酶活性方面无明显的协同作用和叠加效果。
Objectives To build pressure ulcer model induced by ischemia-reperfusion injury in rats, compare the protective effect of pretreatment, posttreatment and combined treatment of reperfusion injury on rat skin and subcutaneous tissue, and provide a theoretical basis for the assessment of injurious degree and intervention effect of pressure ulcer in clinic.Methods 60 Sprague-Dawlye rats were equally randomized divided into three groups: control group (group S), ischemia-reperfusion group (group IR), and ischemic pretreatment and ischemic postconditioning group (group combined). The extent of decompression was observed and the oxygen free radical was detected to assess the injurious degree of pressure ulcer in the model.Results The incidence of pressure ulcer at stageⅠin group Combined and group IR were 100%. The serum concentration of nitric oxide (NO)(40.2±1.3) μmol/L and and group IR malondialdehyde(MDA)(5.3±0.4) nmol/mL in group combined were higher than that in group S(P<0.005). The activity of superoxide dismutasein(SOD)(122.0±7.3)U/mL in group combined were higher than that in group IR but lower than that in group S(P<0.001). Conclusions Combined ischemic treatment has a protective effect on pressure ulcer induced by ischemia reperfusion injury. But it has no obvious synergy effect neither in decreasing the levels of MDA, NO nor in increasing the activity of SOD.
压疮(pressure ulcer)是局部组织长期受压, 引起神经营养紊乱、血液循环障碍使局部组织持续缺血, 组织营养缺乏而致的软组织溃烂和坏死。压力和营养因素是压疮发生、发展的关键因素, 及时减压使组织恢复缺血再灌注是目前预防压疮的“ 金方法” [1], 然而, 缺血再灌注期间产生的氧自由基是引起组织缺血再灌注损伤的重要因素, 缺血再灌注会加重细胞和组织的损伤[2, 3]。大量研究结果表明, 缺血预处理(ischemic preconditioning, IPC)和缺血后处理(ischemic postconditioning, I-PostC)在心、脑、肾等脏器的缺血再灌注损伤中有显著的保护作用 [4, 5, 6], 我们前期的研究结果也证实了I-PostC对骨骼肌的损伤具有保护作用[7], 但关于缺血预处理和后处理联合应用(IPC+I-PostC)对压疮缺血再灌注损伤是否有协同或叠加的作用尚未见有报道。
本研究通过外加物理压力复制再灌注损伤SD(Sprague-Dawlye)大鼠压疮动物模型, 模拟临床上缺血联合处理的干预方法, 观察压疮发生早期血清一氧化氮(nitric oxide, NO)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)的含量, 探讨缺血联合处理对压疮微循环缺血再灌注损伤是否同样具有保护作用, 探讨该方法对SD大鼠皮肤及皮下组织在肉眼及血清氧自由基方面的损伤情况, 以及氧自由基参与压疮发生的保护性处理的效果。为临床压疮的预防和处理提供科学的理论依据。
健康雄性SD大鼠60只, SPF级, 体质量220~250克, 由中山大学动物实验中心提供, 分笼饲养于安静室温环境, 自由进食、饮水, 在新环境中熟悉1周后进行实验。
超净工作台(SW-CT-EFD)、电子称、按压帽、压力产生装置、空气压缩机、数码相机、离心机、HARRIS INC超低温冰箱(-70℃)、BX50-OLYMPUS 光学显微镜、外科手术器械一套(上海金粒医疗器械)。主要试剂:10%水合氯醛、SOD测定试剂盒、MDA测定试剂盒、NO测定试剂盒、SP免疫组化染色试剂盒、DAB显色试剂盒、蛋白标志物、ECL试剂盒。
1.3.1 动物模型制作
选取成年雄性SD大鼠制作缺血再灌注性压疮模型。按400 mg/kg剂量, 腹腔注射10%水合氯醛, 麻醉实验大鼠。选取大腿股薄肌部位面积约2 cm× 2 cm, 剪去腿部毛发。将大鼠俯卧于加压装置下, 胶布固定四肢, 连接空气压缩机与压力汽缸, 将压力装置接触面垂直作用于大鼠大腿股薄肌处。该实验使大鼠大腿股薄肌处皮肤组织在412.5 mmHg(1 mmHg=0.33 kPa)压力下持续受压2 h。
1.3.2 动物模型分组及处理
随机分为3组, 每组20只。①对照组(control group, S组):10%水合氯醛(300 mg)腹腔注射麻醉后俯卧固定于大鼠固定板上, 不施加任何压力, 放置2 h后处死取血3 mL; ②缺血再灌注 (ischemia-reperfusion, IR)组:麻醉后俯卧固定于大鼠固定板上持续施压2 h, 解压2 h后处死取血3 mL; ③联合处理组(IPC +I-PostC组):压迫10 min后解压10 min, 连续三个循环后再持续施压2 h, 解压后即刻行压迫10 min后解压10 min , 连续三个循环, 恢复血流灌注后2 h, 在麻醉下取腹主动脉血3 mL后予空气栓塞处死。所有血标本均分装于EP试管中, 离心取血清保存于-70 ℃冰箱。
1.3.3 肉眼观察大鼠受压部位皮肤压疮的发生率及分度
肉眼观察受压部位皮肤形态学、颜色及皮肤的完整性变化。采用美国压疮学会的分类法, 即分为Ⅰ 度压疮、Ⅱ 度压疮、Ⅲ 度压疮、Ⅳ 度压疮[1]。
1.3.4 血清中SOD活力测定
采用黄嚓吟氧化酶法测定SOD活力。利用722型分光光度计在550 nm波下测定吸光度, 通过公式计算SOD活力, 酶活性规定为每毫升反应液中SOD抑制率达到50%时所对应的SOD量[8]。
1.3.5 血清中MDA含量测定
利用722型可见光分光光度计在532 nm波长下测定吸光度, 并利用公式计算其含量[9]。
1.3.6 血清中NO含量测定
采用硝酸还原酶化学比色法测定NO含量, NO遇氧及水生成硝酸盐及亚硝酸盐, 后二者遇硝酸盐显色剂可生成淡红色偶氮化合物, 利用722型可见光分光光度计在550 nm波下测定吸光度, 检测出血清中NO的含量[10]。
计量资料采用t检验, 计数资料采用χ 2检验, 压疮发生率比较、皮肤压伤程度比较采用有序多分类资料的秩和检验。组间比较采用单因素方差分析, 实验组与对照组之间的比较使用Dunnett-t检验, 数据用(
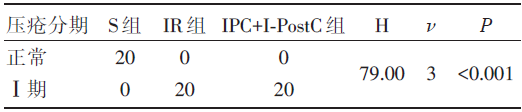
三组大鼠均未出现肉眼可见的皮肤破损等严重变化, 但IR组、IPC+I-PostC组局部皮肤肉眼观察可见压红现象, 出现Ⅰ 期压疮。S组、IR组、IPC+I-PostC组压疮发生的总体分布不完全相同, 见表1。
| 表1 三组受压部位皮肤压疮发生率的比较 |
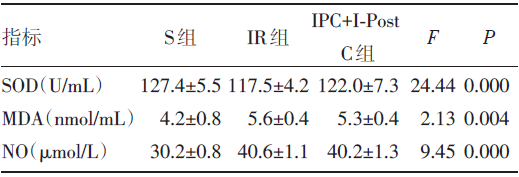
各组大鼠血清中SOD活力、MDA和NO的含量比较提示, 差异有统计学意义(P值均< 0.05), 见表2。IPC+I-PostC组SOD活力低于S组, 明显高于IR组; IPC+I-PostC组MDA、NO含量高于S组, 低于IR组, 差异有统计学意义(P值均< 0.05)。
| 表2 三组大鼠血清SOD、MDA、NO 水平比较 |
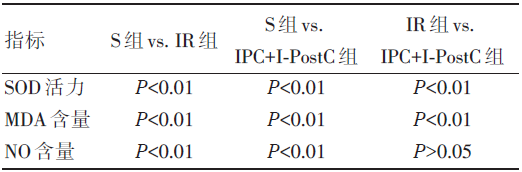
两两比较发现, S组与其它两组的三项指标的差异均有统计学意义(P< 0.01); IR组与IPC+I-PostC组的SOD活力、MDA含量差异有统计学意义(P< 0.01), NO含量的差异无统计学意义(P> 0.05), 见表3。
| 表3 三组大鼠血清SOD 活力、MDA、NO 含量两两比较 |
临床上长期卧床患者在较长时间不翻身的情况下也未发生压疮, 其原因可能是人体皮肤或肌肉组织通过自身调节提高了局部压力耐受性。有学者以猪建立压疮模型研究短时间受压和长时间受压的不同反应, 发现长时间受压后组织可出现一定的适应性 [6]。这可能与皮肤组织对压力的耐受力逐渐增强有关。通过逐步延长翻身间隔时间, 反复的压力刺激, 在一定程度上促进了毛细血管的增生和开放, 增强了皮肤毛细血管承受压力的能力[11, 12]。以上研究为缺血再灌注性压疮早期处理提供了理论基础。缺血处理是一种非常有效的内源性保护机制, 主要通过轻度的缺血应激作用激活, 从而加强压疮缺血再灌注性损伤的抵抗力[12]。缺血后处理也是一种有效的内源性保护机制, 与缺血预处理具有类似的作用[7]。缺血预处理和后处理联合应用在心肌损伤中的保护作用已有研究证实[13], 但该处理方法在皮肤肌肉缺血再灌注损伤中是否同样具有保护性作用未见报道。
SOD能清除超氧阴离子自由基, 保护细胞免受损伤, 对机体的氧化与抗氧化平衡起着至关重要的作用[2], MDA是脂质过氧化反应的产物, 其含量的多少可以反映组织的脂质过氧化反应的速度和强度[14]。NO是体内的一种反应性极强的自由基, 具有广泛的生理作用, 压疮等组织损伤可影响血液循环中NO的生成[15]。本研究显示, 除S组外, 其他各组Ⅰ 期压疮发生率为100%, 成功建立大鼠Ⅰ 期压疮模型。IPC+I-PostC组与其他各组比较, MDA[(5.3± 0.4)nmol/mL]、NO[(40.2± 1.3)μ mol/L]含量高于S组, 低于IR组; SOD[(122.0± 7.3)U/mL]活性低于S组, 高于RI组, 两两比较差异显著(P< 0.01)。说明IPC+I-PostC的保护作用可有效减轻压疮缺血再灌注性损伤, 可能通过对血管的保护, 减轻缺血后微血管床的闭塞; 也可能与IPC+I-PostC可缓解缺血再灌注性损伤引起的组织中高氧状态有关。同时可能与缺血再灌注期间组织内可爆发生成大量的超氧阴离子自由基, 而导致细胞膜脂质过氧化和细胞其它成分发生氧化损伤有关。此现象说明在肢体受压后有大量的脂质过氧化反应的产物和氧自由基产生, 血清中SOD活力和MDA含量存在负性相关。因此证明, IPC+I-PostC产生的少量自由基可启动内源性的保护作用以维持线粒体的完整性, 减少在缺血再灌注过程中因线粒体受损而产生大量自由基, 减轻氧化应激损伤和功能缺失, 保护了缺血组织, 有效缓解了压疮缺血再灌注性损伤, 为临床压疮的防护提供了理论依据。同时通过IPC+I-PostC的保护作用可有效减轻压疮缺血再灌注损伤, 从而减轻氧自由基的爆发产生。再灌注损伤导致的氧自由基的损伤是可以干预的, 从而提示我们可以从减轻组织自由基损伤的角度预防缺氧再灌注损伤对细胞的结构和功能的破坏。
研究结果表明, IPC和I-PostC两者联合使用在对大鼠缺血再灌注损伤性压疮具有显著的保护作用, 但该联合处理方法在降低MDA和NO水平、增加SOD活性方面与笔者前期的后处理结果相比并无明显的协同作用和叠加效果, 提示两者可能存在共同的信号通路机制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|