作者简介: 谢至(1984-),女,湖南常德人,本科,从事分子病理方面的工作。
目的 评价SP142和E1L3N两种兔单克隆抗体在临床肺癌标本中检测结果的一致性。方法 连续收集了158例临床肺癌标本,制备成中性甲醛固定石蜡包埋的样品,采用SP142和E1L3N抗体,优化免疫组织化学方法检测PD-L1在肿瘤细胞和免疫细胞的表达情况。采用卡方检验和相关系数分析检出率和HScore得分的一致性和差异性。结果 在158例肺癌组织中,SP142和E1L3N抗体检出的PD-L1总阳性率为54.4%(86/158)和62.7%(99/158)。两种抗体在肿瘤细胞染色分布较一致。当肿瘤细胞阳性比例(TPS)在1%≤TPS<5%、5%≤TPS<50%和TPS≥50%区间时,SP142抗体的检出阳性率分别为6.3%、17.1%和24.1%,E1L3N抗体的检出阳性率分别为7.6%、22.8%和26.6%,两种抗体的检测率总体上具有一致性(P=0.368)。当考虑染色强度时,肿瘤细胞HScore得分总体上相关性好(r=0.624, P=0.001)。但在所有TPS≥5%或TPS≥50%的阳性标本中,有43.9%(40/91)或42.0%(21/50)具有不一致性。在免疫炎症细胞检测中,两种抗体的染色分布异质性大。以1%为界值,SP142抗体和E1L3N抗体的检出率分别为19.6%和16.5%。结论 SP142和E1L3N两种兔单克隆抗体采用优化的免疫组织化学方法检测临床非小细胞肺癌标本中肿瘤细胞比例具有较好的一致性。两种抗体联合检测具有互补性,可能有助于检测出更多阳性患者用于临床治疗参考。
Objective This study aims to evaluate the PD-L1 expression testing concordance in Chinese non-small cell lung cancer (NSCLC) using two antibodies of SP142 and E1L3N.MethodsTissue samples of a consecutive 158 cases of NSCLC were made into formalin-fixed and paraffin embedded (FFPE) blocks. Optimized immunohistochemistry (IHC) using SP142 and E1L3N were established and then PD-L1 expression tests were carried out on the cancer tissue samples and immune cells. Tumor proportion score (TPS) and Histo-Score (HScore) were calculated for the evaluation of PD-L1 expression. Chi square test and bivariate correlation test were performed for the statistical analysis of the data.ResultsIn the cohort of 158 cases of NSCLC, PD-L1 expression positivity by SP142 and E1L3N were 54.4% (86/158) and 62.7% (99/158) separately. The staining patterns of these two antibodies on tumor cells were similar. When TPS set in intervals of 1%≤TPS<5%, 5%≤TPS<50%, TPS≥50%, PD-L1 positivity by SP142 were 6.3%, 17.1% and 24.1%, and positivity by E1L3N were 7.6%, 22.8% and 26.6% separately, showing the similar results by two antibodies (P=0.368). Taking staining intensity into account, bivariate test showed HScore values of two antibodies had good correlation (r=0.624, P=0.001). However, in all positive samples if cut-point set as TPS≥5% or TPS≥50%, there are discrepancies of 43.9% (40/91) or 42.0% (21/50) of PD-L1 positivity between the two antibodies. In evaluating immune cells, the staining patterns of the two antibodies were heterogeneous, and if cut-off set at 1%, positivity of PD-L1 expression in immune cells were 19.6% and 16.5% separately.ConclusionAntibodies of SP142 and E1L3N have good concordance in terms of PD-L1 detection rate and staining patterns under the condition of optimized IHC. IHC by the two antibodies may be complimentary to detect PD-L1 positive cases as more as possible for clinical reference.
近年来, 肿瘤免疫治疗取得了长足的进展, 针对程序性死亡蛋白受体1(programmed death protein receptor 1, PD-1)及其配体(programmed death protein receptor ligand 1, PD-L1)等免疫检查点抗体药物在黑色素瘤、肺癌等多个瘤种中取得了显著疗效, 已被美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于临床治疗[1, 2, 3, 4]。但在肺癌系列临床试验中, 单药免疫抗体药物的客观有效率在20%左右[5]。尽管PD-L1的免疫组织化学检测方法已经被FDA批准为伴随诊断, 但仍然存在两个问题:其一, PD-L1的检测方法存在多个平台、多种抗体、多个评价方法的统一性问题; 其二, PD-L1表达分析不能100%精准选择患者接受昂贵的免疫治疗。不同抗体的免疫组化分析方法在我国肺癌中的分析资料尚不充分, 在我国也没有任何一个商业化的试剂盒和平台可用。本研究在实验室优化组织化学分析方法的基础上, 连续收集肺癌临床标本, 分析比较SP142和E1L3N两种兔单克隆抗体的检测效果一致性和差异性及临床应用潜力。
选取2015-2017年广东省人民医院肺癌研究所标本库中的非小细胞肺癌患者的石蜡标本158例。男性92例, 女性66例, 中位年龄57岁。标本收集均获得书面知情同意和伦理审批。采集临床相关信息, 包括一般情况:性别、年龄、病理类型、吸烟状态等, 所有标本均按照组织标本包埋的标准流程处理, 且由病理科医生评估。
兔单克隆抗PD-L1抗体SP142(Biospring, USA), 兔单克隆抗PD-L1抗体E1L3N(CST, USA)均购自基因公司。二抗试剂盒HRP鼠兔双抗及DAB显色系统, 购自DAKO公司(K5007, DAKO)。自配pH 9.0的Tris-EDTA修复液, 中性磷酸缓冲液PBS购自基因公司。
所有石蜡标本切片厚度均为4 μ m, 60℃烤片2 h, 经常规脱蜡及水化后采用pH 9.0的Tris-EDTA修复液高压修复3 min, 室温冷却后水洗, 3%H2O2封闭10 min, PBS洗涤后室温孵育一抗1 h, PBS再次洗涤后室温孵育二抗30 min, PBS第三次洗涤后DAB显色, 观察到镜下出现棕褐色显色即终止反应, 最后苏木素复染、酒精脱水、二甲苯透明后封片。在显微镜下观察分析PD-L1表达情况并拍照。
免疫组化染色后, 在显微镜下评价PD-L1染色得分。TPS(tumor proportion score)指肿瘤细胞中染色阳性的细胞比例。本实验将1%≤ TPS< 5%, 5%≤ TPS< 50%, TPS≥ 50%作为阳性表达区间进行分析。HScore是指将染色阳性细胞比例乘以染色强度的积值。
采用SPSS 20. 0统计软件包进行统计学处理, 计数资料采用χ 2检验, 以P< 0.05为差异有统计学意义。对于HScore得分采用相关系数分析。
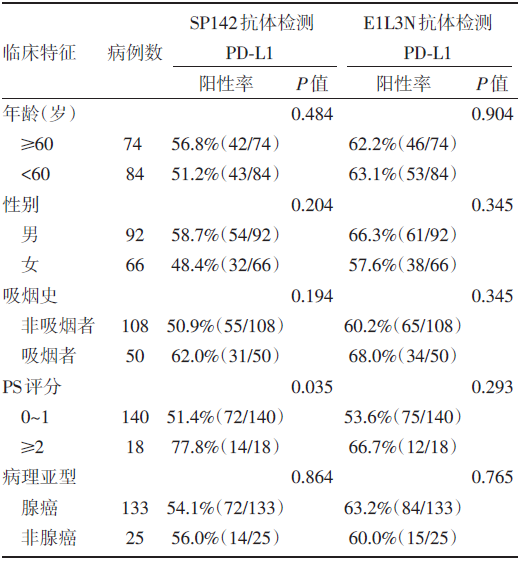
2015-2017年, 总共纳入广东省肺癌研究所的158名肺癌患者, 临床特征见表1。患者主要为PS 0~1分非吸烟的腺癌患者。SP142抗体、E1L3N抗体检出PD-L1的阳性率与研究人群的年龄、性别、病理类型、吸烟史无相关性。
| 表1 患者的人口学和病例特征与PD-L1 检出情况 |
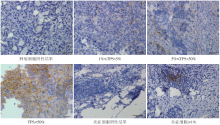
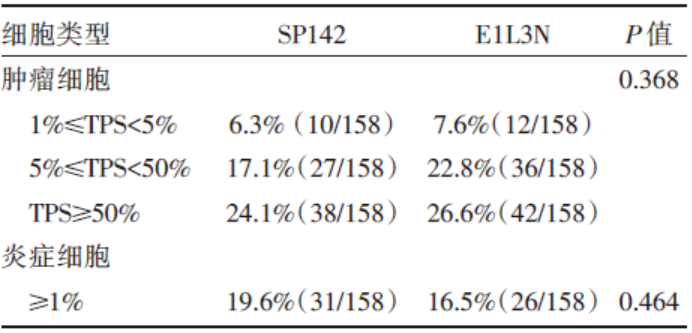
采用TPS方法评价得分, SP142抗体组中PD-L1总阳性率为54.4%(86/158), E1L3N抗体组中PD-L1总阳性率为62.7%(99/158), 两者间具有一致性(P=0.053)。采用肿瘤细胞阳性比例(TPS)在1%≤ TPS< 5%、5%≤ TPS< 50%和TPS≥ 50%区间中, SP142抗体的检出阳性率分别为6.3%、17.1%和24.1%, 而E1L3N抗体的检出阳性率分别为7.6%、22.8%和26.6%, 两种抗体的检测率总体上具有一致性(P=0.368), 见表2。当考虑染色强度时, 肿瘤细胞HScore得分总体上相关性好(r=0.624, P=0.001)。SP142抗体检测PD-L1表达的免疫组化图见图1。
| 表2 两种抗体按照TPS 分层的PD⁃L1 阳性率比较 |
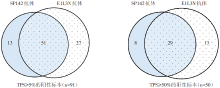
在所有TPS≥ 5%和TPS≥ 50%的阳性标本中, 43.9%(40/91)和42.0%(21/50)具有不一致性, 见图2。在免疫炎症细胞检测中, 两种抗体的染色分布异质性大。
近年来, 采用免疫检查点CTLA4、PD-1、PD-L1等靶向抗体的肿瘤免疫治疗取得了巨大进步, 在多个肿瘤类型呈现疗效, 患者生存期得到显著延长, 相关药物获得了美国FDA的批准上市[1, 4, 6]。我国目前正在开展相关临床试验, 多家本土药企也在研发相关抗体药物, 竞争激烈。但免疫治疗并非所有患者都能获益, 需要生物标志物检测分析选择患者指导治疗。相应伴随诊断标志物主要为肿瘤病灶中PD-L1的表达分析。CD274或B7H1(PD-L1)于1999年被发现并证实与癌症免疫相关[7, 8]。肿瘤表面表达的PD-L1与效应T细胞表面的受体PD-1结合能够抑制T细胞的细胞毒活性和增殖能力。PD-L1除了可表达于肿瘤细胞, 也可能表达于其他免疫细胞, 如Treg、MDSC等[9]。
PD-L1在肿瘤细胞中高表达可能与预后相关。在PD-L1表达阳性或高表达的患者肿瘤中, PD-1/PD-L1等抗体药物的疗效更好, 客观有效率更高。但目前国际市场上存在的检测方法多种多样, 使用的抗体、检测平台、评价方法都存在差异。因而如何促进各种检测方法的可靠性及相互之间的参比具有重要意义, 这对于临床选择患者或者比较不同临床试验的结果很重要。国际上出现了几种使用率较高的抗体包括22C3、SP142、SP263、E1L3N以及28-8等[5]。
本研究比较分析了SP142与E1L3N两种抗体在临床肺癌患者中的检测结果。结果发现在158例肺癌组织中, SP142和E1L3N抗体检出的PD-L1总阳性率为54.4%(86/158)和62.7%(99/158)。两种抗体在肿瘤细胞染色分布较一致。当肿瘤细胞阳性比例(TPS)在1%≤ TPS< 5%、5%≤ TPS< 50%、TPS≥ 50%区间中, SP142抗体的检出阳性率分别为6.3%、17.1%和24.1%, 而E1L3N抗体的检出阳性率分别为7.6%、22.8%和26.6%, 两种抗体的检测率总体上具有一致性(P=0.368)。当考虑染色强度时, 肿瘤细胞HScore得分总体上相关性好(r=0.624, P=0.001)。但在所有TPS≥ 5%或TPS≥ 50%的阳性标本中, 有43.9%(40/91)或42.0%(21/50)具有不一致性。提示仅从肿瘤细胞染色阳性比例来看, 两种抗体检测无显著差别, 但在染色强度方面存在一定的差别。
在免疫炎症细胞检测中, 两种抗体的染色分布异质性大。以1%为界值, SP142抗体和E1L3N抗体的检出率分别为19.6%和16.5%。可见, 在免疫细胞染色分析方面, 抗体染色具有异质性, 但总体检出率无显著差别。
本研究与国际肺癌研究学会(IASLC)开展的Blueprint 1.0/2.0研究结果相似。在Blueprint研究的两个阶段中, 分别比较了22C3、SP142、SP263、E1L3N以及28-8等抗体在肺癌标本中的一致性, 结果发现, 在肿瘤细胞中, SP142的染色相对低于其他抗体, 但总体检出的一致性较好。在免疫细胞中分析PD-L1表达时, 则发现各种抗体染色表现出很大的异质性, 即不同抗体染色的免疫细胞可能不同且染色强度也存在明显差异[10]。
本研究采用了自身优化的方法, 在初步研究中设有预制的阴性、阳性对照标本, 做了反复优化。然后在临床标本中分析时, 每次分析均采用阴性和阳性标本进行质控, 保证结果的可靠性。本研究的患者PD-L1表达阳性率、染色类型和免疫细胞染色状态与Blueprint研究的结果均相似。本研究也存在样本例数仍需扩大、未能获得其他抗体进行比较、未能在Ventana等自动化平台上分析、未能与临床疗效进行关联分析等不足之处。在下一步研究中, 我们将采用该检测方法与临床免疫治疗效果相结合研究其应用价值。
综上, 本研究提供了临床标本验证的PD-L1表达免疫组织化学方法, 发现SP142和E1L3N两种抗体在检测我国非小细胞肺癌标本中肿瘤细胞比例(TPS)具有较好的一致性。对于免疫细胞的检测分析解读需要进一步研究。鉴于部分标本只能被一种抗体检测为阳性, 所以两种抗体联合应用检测具有互补性, 可能有助于检测出更多阳性患者用于临床治疗参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|