作者简介:陈明教授,毕业于苏州医学院、上海医科大学和武汉大学,密歇根大学博士后。先后任职于中山大学肿瘤医院和浙江省肿瘤医院。中山大学和苏州大学教授,十三五国家重点研发计划专项“基于大数据和人工智能的远程放疗服务模式研究”首席专家,浙江省有突出贡献的中青年专家,享受国务院政府特殊津贴。曾任中山大学肺癌研究中心副主任,华南肿瘤学国家重点实验室肺癌与放射生物室主任。现任浙江省肿瘤医院副院长,浙江省放射肿瘤学重点实验室主任,浙江省肺癌诊治研究中心主任。中华医学会放射肿瘤学分会常委兼秘书长。致力于肺癌和食管癌的临床和研究,第一完成人获教育部科技进步二等奖和浙江省医学进步一等奖,三项研究成果被美国NCCN肺癌临床指南引用,改写了国际标准。
Yang JJ, Zhou CC, Huang YS, et al. Icotinib versus whole-brain irradiation in patients with EGFR-mutant non-small-cell lung cancer and multiple brain metastases (BRAIN): A multicentre, phase 3, open-label, parallel, randomised controlled trial[J]. Lancet Respir Med, 2017, 5(9): 707-716.
1b。
• 目前全脑放疗(whole-brain radiation therapy, WBRT)仍是非小细胞肺癌(non-small cell lung cancer, NSCLC)多发性脑转移的标准治疗方式, 而对于EGFR突变的患者, 第一代和第二代TKI不仅显著提高了无进展生存期, 而且对脑转移有一定的疗效。
• 对EGFR突变伴随多发脑转移的患者, EGFR-TKI和WBRT哪个方案更优尚不明确。
探讨EGFR突变伴随多发脑转移NSCLC患者埃克替尼的疗效是否优于WBRT± 化疗。
• 研究条件: 中国胸部肿瘤协作组(Chinese Thoracic Oncology Group, CTONG)的临床试验协作项目(BRAIN)。
• 研究起止时间:2012年12月10日至2015年6月30日。
• 研究方法:多中心, Ⅲ 期, 随机对照临床试验。
• 研究对象:有EGFR突变、伴随至少3个脑转移灶的NSCLC, 此前未接受过EGFR-TKI或者放疗。入选患者须18周岁以上且ECOG PS评分0~1分。
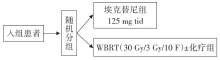
• 干预措施:BRAIN研究的干预措施和流程见图1。
• 评价指标:主要评价指标为颅内PFS, 次要评价指标包括颅外PFS、颅内客观缓解率、总生存期、安全性等。
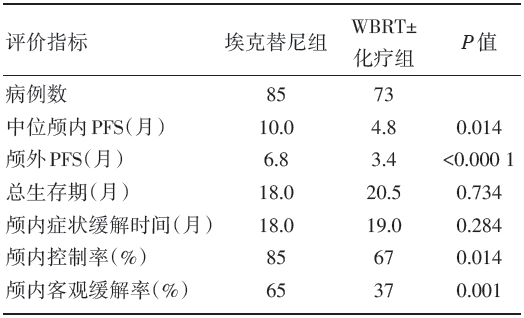
共入组EGFR突变、伴随多发脑转移的NSCLC患者176例。WBRT± 化疗组有18例因个人原因退出研究, 最终纳入患者158例, 其中埃克替尼组85例, WBRT± 化疗组73例。中位随访时间为16.5个月。两组患者的主要结局指标和不良反应事件见表1和表2。
| 表1 BRAIN 研究的主要结局指标 |
| 表2 BRAIN 研究的严重不良反应事件 |
对于EGFR突变、伴随多发脑转移的NSCLC, 埃克替尼组显著延长了颅内及颅外PFS; 埃克替尼组的严重不良反应事件发生率较WBRT± 化疗组低。
脑是NSCLC常见的转移部位, 约50%的晚期NSCLC在病程中会出现脑转移; 携带EGFR驱动基因突变的NSCLC脑转移发生率更高[1], 所幸的是预后相对较好 [2]。对这部分患者, 如何合理选择治疗手段, 以改善生存和保障生活质量是目前研究的热点。
吴一龙教授团队的BRAIN研究(CTONG1201)是全球首项旨在对比埃克替尼与WBRT治疗EGFR 突变、多发脑转移NSCLC的疗效和安全性的多中心随机开放平行对照Ⅲ 期临床试验。该研究入组PS评分为0~1分、存在超过3个脑转移灶、有EGFR 突变的晚期NSCLC患者共176例, 随机分到埃克替尼组或WBRT± 化疗组。研究的主要研究终点指标是颅内PFS。结果发现埃克替尼组中位颅内 PFS为10个月(95%可信区间5.6~14.4个月), 高于WBRT± 化疗组的4.8个月(95%可信区间2.4~7.2个月, 风险比0.56, 95%可信区间0.36~0.90, P=0.014), 此外, 埃克替尼组和WBRT± 化疗组3级以上不良事件发生率分别为8%和38%[3, 4]。
BRAIN研究首次证实埃克替尼可显著提高EGFR突变多发脑转移NSCLC患者的颅内PFS和颅外PFS, 获得更优的客观缓解率及疾病控制率; 埃克替尼的安全性也优于 WBRT。
BRAIN研究证实了酪氨酸激酶抑制剂(TKI)作为EGFR 突变多发脑转移NSCLC治疗的基石地位。国内外学者今后设计此类研究, BRAIN研究的方法和结论可作为重要参考, 引起了国内外同行的广泛关注和思考。
在BRAIN研究中, 两组患者的总生存期并没有差异。原因在于埃克替尼组患者71%后续需要埃克替尼联合WBRT或化疗; 在WBRT组, 81%的患者后续需要埃克替尼治疗, 两组治疗手段交叉的结果平衡了总生存期的最终结果, 说明脑部放疗及TKI均为这类患者重要的治疗手段, TKI应与放疗联合使用。联合治疗的理论依据有:肺原发灶与脑转移灶EGFR突变状况并不总是一致、EGFR突变的肿瘤细胞本身对放疗敏感、放疗可增加血脑屏障的通透性[5]以及TKI耐药不可避免。仅从现有的资料来看, 联合治疗的疗效还存在争议。不少研究发现TKI联合WBRT的颅内反应率达到52.6%~87.8%, 中位颅内PFS 为6.6~18个月, 中位总生存期达12.9~26个月, 优于单纯TKI治疗[7, 8, 9]。而在上海同济大学肺科医院的回顾性分析中[10], EGFR突变脑转移患者, 初次诊断脑转移者121例, 91例仅予TKI治疗, 30例予TKI+WBRT, 只有四分之一的患者接受放疗, 比例之低折射出不同医院间治疗模式的差异, 内科医生推荐放疗的这部分患者与他们认为不需要放疗的患者之间的可比性存疑。
BRAIN研究没有选用总生存期作为主要研究终点指标。近来Magnuson等对比了TKI与WBRT或立体定向放疗不同的联合方式对总生存期影响的研究引发学术界广泛讨论。该研究分析了6个中心351例EGFR敏感突变的肺腺癌脑转移患者, 发现先脑部放疗(1~3个转移灶采用立体定向放疗, 多转移灶采用WBRT)较延迟脑放疗组(先TKI, 待脑转移瘤进展再采用WBRT或立体定向放疗)显著延长生存期, 先立体定向放疗组、先WBRT组和先TKI组的总生存期分别是46个月、30个月和25个月[11]。结论与他们之前发表的研究类似, 即尽早行脑放疗可显著改善EGFR敏感性突变的NSCLC脑转移患者的生存[12]。迄今为止, 总生存期仍是衡量多发性脑转移治疗极为重要的观察指标。
再者, 传统WBRT有神经认知功能损伤的副作用, 如记忆力和认知力的减退, 但目前尚无WBRT联合TKI导致神经毒性增加的报道[6]。对WBRT进行技术改进, 降低其神经认知功能毒性有望解决这一难题[13]。成人海马齿状回的颗粒细胞亚区形成的神经前体细胞及新的神经元对维持学习记忆等具有重要作用, 对射线敏感。而这一区域及区域外5 mm区域发生脑转移瘤概率很小。利用螺旋断层放疗技术(TOMO)及容积调强技术(VMAT)行海马保护的WBRT, 较传统WBRT对患者神经认知功能影响小, 这一技术还可以保护眼睛、中耳内耳、头皮毛囊。而且, 还能对局部肿瘤同期进行适度的加量, 增强肿瘤的局部控制, 值得进一步研究[14]。另外, 近年来立体定向放疗治疗脑转移的适应证正在拓展, 超过3个转移灶使用立体定向放疗的研究显示出优于WBRT的趋势。
药物及技术的进步改变了我们对NSCLC多发脑转移的认知。合理地对现有治疗手段进行最优化组合, 延长患者生存期同时保障生活质量及神经认知功能, 是我们面临的一项重大课题。笔者斗胆预言:有效且能透过血脑屏障的药物将不断出现, 但还不足以独撑大局; 聚焦肿瘤且微创的放疗技术将不断完善, 其作用历久弥新。在EGFR驱动基因突变的NSCLC脑转移瘤的治疗上, EGFR-TKI与脑部放疗新技术的“ 珠联璧合” 值得研究, 值得期待。在BRAIN研究奠定TKI的基础性地位之后, 下一步需要研究的重点是早放疗vs. 晚放疗; 序贯vs. 同步。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|