作者简介:王洁,中国医学科学院肿瘤医院内科主任医师、教授、博士研究生导师。国家杰出青年基金获得者,获第七届中国青年女科学家奖,为教育部创新团队带头人,2014年入选国家百千万人才工程并获有突出贡献中青年专家称号,国务院政府特殊津贴享受者。中国抗癌协会肺癌专业委员会副主任委员,中国临床肿瘤学会执行委员,北京医学会肿瘤学分会副主任委员。担任《中华结核与呼吸杂志》、《中国肺癌杂志》、《Lung Cancer》、《Clin Lung Cancer》编委。作为课题负责人多次承担国家自然科学基金重点及面上、国家863科技支撑项目。在国内外肿瘤核心期刊《J Clin Oncol》、《Cancer Res》、《Clin Cancer Res》及《PNAS》等杂志发表论文百余篇。
Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M-positive lung cancer[J]. N Engl J Med, 2017, 376(7): 629-640.
1b。
奥希替尼是一种第三代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI), 选择性地作用于EGFR-TKI敏感突变和继发性T790M 耐药突变的非小细胞肺癌(non-small cell lung cancer, NSCLC)患者。
奥希替尼与培美曲塞联合铂类化疗在第一代EGFR-TKI 耐药后的NSCLC患者中的疗效和安全性尚不明确。
比较奥希替尼与培美曲塞联合铂类化疗在EGFR T790M阳性的晚期非小细胞肺癌患者中一线治疗的疗效与安全性。
• 研究条件:126个医学研究中心参与的AURA3研究。
• 研究方法:国际、多中心、开放、Ⅲ 期、随机对照临床试验。
• 研究起止时间:2014年8月至2015年9月。
• 研究对象:诊断明确的Ⅲ B/Ⅳ 期NSCLC患者, 一线EGFR-TKI治疗后疾病进展, 有EGFR敏感突变和经研究中心确认EGFR-TKI耐药后T790M突变阳性, 允许存在无症状或稳定的中枢神经系统转移, 但要求接受研究药物治疗前至少1个月没有接受激素治疗, 所有患者均要求提供血标本检测T790M突变状态。
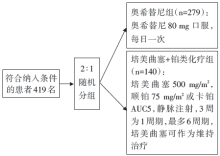
• 干预措施:419名纳入研究的患者按2∶ 1比例随机分组, 279名患者接受奥希替尼治疗, 140名患者接受培美曲塞联合铂类化疗。流程见图1。
• 评价指标:主要研究终点指标为无进展生存期(progression-free survival, PFS), 次要终点指标为客观缓解率(objective response rate, ORR)、疾病控制率及安全性。
本研究共纳入419名符合入选标准的患者, 其中279名患者进入奥希替尼组, 140名患者进入联合化疗组, 两组患者临床特征均衡性良好。所有患者的中位随访时间为8.3个月, 在截止日期前, 两组的中位治疗持续时间为8.6个月 vs. 4.8个月。联合化疗组中的136人(97%)接受了治疗, 100人(74%)接受了至少4周期的培美曲塞联合铂类化疗, 73人(54%)接受培美曲塞单药维持治疗。到截止日期为止, 奥希替尼组有166名(59%)患者、联合化疗组有16名(12%)患者仍在接受治疗。
奥希替尼组PFS显著长于化疗组[中位PFS 10.1个月vs. 4.4个月, 风险比(hazard ratio, HR)=0.30, P< 0.001]。该结果与盲法独立中央审查(blinded independent central review, BICR)的分析结果一致。在BICR的分析中, 奥希替尼组和联合化疗组的中位PFS为11.0个月 vs. 4.2个月(HR=0.28, P< 0.001)。在脑转移亚组中, 奥希替尼组较联合化疗组的中位PFS也是明显改善 (8.5个月 vs. 4.2个月, HR=0.32)。根据不同的敏感突变进行亚组分析, 发现EGFR 19缺失和L858R突变两个亚组的疾病无进展HR分别为0.34和0.46。亚裔对比非亚裔患者疾病无进展HR分别为0.32和0.48。血浆和组织中均有T790M突变阳性的患者中, 奥希替尼组和化疗组的中位PFS是8.2个月vs. 4.2个月(HR=0.42)。接受奥希替尼治疗的患者, 同时合并血检T790M阳性者与血检T790M阴性患者疗效无显著差异。
奥希替尼组患者的ORR和疾病控制率也明显优于联合化疗组, 分别为71% vs. 31%[比值比(odds ratio, OR)=5.39]和93% vs. 74%(OR=4.76); 奥希替尼组的中位缓解持续时间为9.7个月, 而联合化疗组仅为4.1个月。奥希替尼组和联合化疗组6个月、12个月疾病无进展率分别为69% vs. 37%和44% vs. 10%。死亡率分别为13%和19%。具体见表1。
| 表1 AURA3 研究中两组患者的疗效比较 |
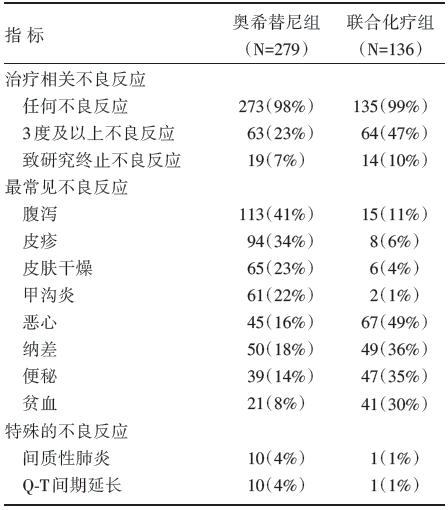
奥希替尼组治疗相关的不良事件与联合化疗组相当(98% vs. 99%), 但其3度及以上不良事件发生率(23% vs. 47%)低于联合化疗组。奥希替尼组因不良事件终止研究的发生率(7% vs. 10%)低于联合化疗组。治疗相关性死亡事件在两组分别是4例(奥希替尼组)和1例(联合化疗组)。具体见表2。
| 表2 AURA3 研究中两组患者的不良事件比较 |
奥希替尼组最常见的不良事件包括腹泻(41%)、皮疹(34%)、皮肤干燥(23%)以及甲沟炎(22%)。联合化疗组最常见的不良事件包括恶心(49%)、纳差(36%)、便秘(35%)、贫血(30%)。奥希替尼组间质性肺炎(4% vs 1%)和Q-T间期延长的发生率(4% vs. 1%)均高于联合化疗组。
对于一线EGFR-TKI治疗后进展, 且EGFR-T790M突变阳性的晚期NSCLC患者(包括有脑转移患者), 奥希替尼较培美曲塞联合铂类化疗的疗效更好, 同时安全性也更好。
有效、合理地应对EGFR-TKI、ALK-TKI等靶向药物的耐药, 实现精准诊断下的全程管理已经成为晚期NSCLC个性化诊疗的主要方向。T790M突变是第一、二代EGFR-TKI最为常见的耐药机制, 作为选择性地作用于EGFR-TKI敏感突变和继发性T790M 耐药突变的第三代表皮生长因子受体酪氨酸酶抑制剂[1], 奥希替尼在早期临床试验(AURA1和AURA2)中已经展示出优秀的安全性和有效性[2, 3], 然而奥希替尼相较含铂方案治疗在第一代EGFR-TKI 耐药后的NSCLC患者中的疗效对比尚需前瞻性、多中心临床试验明确。
AURA3研究是比较奥希替尼与培美曲塞联合铂类化疗在EGFR T790M阳性晚期NSCLC患者中一线治疗的疗效与安全性的国际、多中心、开放、Ⅲ 期、随机对照临床试验。结果毫无悬念地奥希替尼完胜化疗(PFS 9.7 个月vs. 4.1个月, HR=0.42; ORR 71% vs. 31%, OR=5.39), 且安全性显著优于化疗。在脑转移亚组中, 奥希替尼组较联合化疗组的中位PFS亦明显改善 (8.5个月vs. 4.2个月, HR=0.32)。血浆和组织均有T790M突变阳性的患者, 奥希替尼组和化疗组的中位PFS是8.2个月vs. 4.2个月(HR=0.42)。
近十年来无数临床研究已经证明肺癌患者在其特有的靶基因检测基础上接受靶向药物治疗, 疗效必定优于传统的化疗, 该研究结果意料之中, 属“ 前有古人, 后有来者” 的结果, 其亮点之处并非于全组生存数据, 而在于证明奥希替尼对T790M阳性无症状脑转移患者的疗效以及血浆ctDNA T790M突变检测对奥希替尼疗效的预测上。
脑转移已然是肺癌靶向治疗时代最富挑战性的难题。第一代EGFR-TKI失败后30%左右以脑(包括脑膜)为主要转移部位, 尤其脑膜转移症状似乎更为隐匿而治疗方案寥寥。该研究显示奥希替尼对T790M突变的脑转移患者的远近期疗效优于化疗, 为脑转移患者提供了新的治疗机会[4]。但对单纯颅内进展, 尤其脑膜进展者, 外周血ctDNA T790M 往往阴性, 对此类患者, 是否脑积液基因检测应更为积极?需进一步研究。
基于液体活检基因分型的精准治疗已经从单纯实验室研究步入临床实践, 颇有“ 忽如一夜春风来, 千树万树梨花开” 之感。但是ctDNA基因分型尚有敏感性不够等局限, 我们对此必须有清醒的认识。血液和组织标本均有自身的局限性, 二者并非严格互排, 而是互相补充, 故当一种标本检测阴性而患者又是驱动基因变异的优势人群, 获取另一种标本进行进一步验证十分必要。AURA3研究再次证明血浆ctDNA T790M突变具有强的预测作用, 但假阴性率亦偏高[5, 6], 此时, 重复组织活检或再次血液检测是克服液体活检敏感性不够的有效方法。
AURA3研究入组的患者均为T790M突变患者, 但奥希替尼的有效率和中位PFS仍分别为71%和9.7个月, 意味着本为克服耐药的靶向治疗依然难逃新一轮耐药的梦魇。随着新的靶向药物、抗肿瘤血管生成药物和免疫治疗药物转化研究和临床应用的不断深入, 未来的靶向治疗应该建立于多基因平行检测的基础上, 对同时携带多种敏感和耐药基因的异质性肿瘤, 应行多种靶向药物联合治疗或靶向药物与抗肿瘤血管生成药物、免疫治疗药物甚或化疗的联合, 以延缓耐药的发生; 此外, 严密监测外周血耐药基因质与量的动态改变, 针对“ 分子耐药” 进行未雨绸缪的干预, 相较临床耐药后亡羊补牢式的治疗可能给患者带来更好的生存时间与质量。对此, 尚需临床研究证据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|