作者简介:杨衿记, 肿瘤学博士,内科肿瘤学主任医师,博士研究生导师。广东省医学科学院&广东省人民医院肿瘤中心主任、肿瘤中心肺一科主任 。广东省抗癌协会肺癌专业委员会主任委员,中国临床肿瘤学协会(CSCO)理事。
曾留学丹麦和美国,主要研修临床肿瘤学早期临床试验。主攻肺癌多学科综合治疗与精准治疗。在研国家自然科学基金面上项目1项(主持人)、在研国家科技部慢病重大项目子课题1项(负责人)。研究方向为双驱动基因肺癌、肺癌c-Met分子信号转导通路、肺癌分子靶向治疗的原发与继发耐药、免疫治疗的精准化。近几年来以第一/通讯作者身份在《 Lancet Respiratory Medicine》、《Annals of Oncology》和《Clinical Cancer Research》等杂志上发表SCI论文18篇,最高IF:19.287。以共同完成人获得国家科技进步二等奖1次、中华医学科技一等奖1次、省科学技术一等奖和二等奖各2次 。
Shaw AT, Felip E, Bauer TM, et al. Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement: An international, multicentre, open-label, single-arm first-in-man phase 1 trial[J]. Lancet Oncol, 2017, 18(12):1590-1599.
1b。
ALK和ROS1重排在非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中都是独特的分子分型[1, 2, 3]。克唑替尼是目前已经批准的ALK和ROS1重排的NSCLC患者的一线用药[4, 5], 但这些患者不可避免地出现耐药。色瑞替尼、艾乐替尼、布加替尼作为ALK的第二代抑制剂对40%~50%的克唑替尼耐药患者有效, 但对ALK G1202R点突变患者疗效不明显。劳拉替尼作为一种第三代、新型、高效、选择性的、脑渗透能力强的ALK和ROS1抑制剂, 低剂量能对ALK G1202R和ROS1 G2032A等点突变的患者起作用[6, 7]。
分析劳拉替尼在晚期ALK或ROS1阳性NSCLC患者的安全性、疗效、最大耐药剂量及药代动力学。
• 研究条件: 美国、西班牙、澳大利亚、法国的5个研究中心参加的临床研究。
• 研究起止时间:2014年1月22日至2015年7月10日。
• 研究方法:国际、多中心、非盲、单臂Ⅰ 期剂量递增临床试验。
• 研究对象:符合入组条件的患者为局部晚期或晚期ALK或ROS1阳性NSCLC, 年龄≥ 18岁、ECOG体能状况评分0~1分、器官功能良好。ALK状态通过荧光原位杂交技术或免疫组化法检测, ROS1状态通过荧光原位杂交技术或反转录酶-聚合酶链锁反应技术或二代测序检测。
• 干预措施:患者口服劳拉替尼, 每天1次, 剂量从10 mg开始到200 mg, 或者每天2次, 从35 mg开始到100 mg; 每一剂量组最少3名患者。对于有些患者, 在劳拉替尼治疗前进行肿瘤活检, 以确定ALK耐药突变情况。在接受过至少劳拉替尼一个剂量的患者中进行安全性评估, 在意向性治疗(ALK或ROS1重排且至少接受劳拉替尼一个剂量)的患者中进行有效性评价。
• 评价指标:主要终点指标是根据调查人员来评估劳拉替尼的剂量限制性毒性; 次要终点指标包括药物安全性、药代动力学和总缓解率。
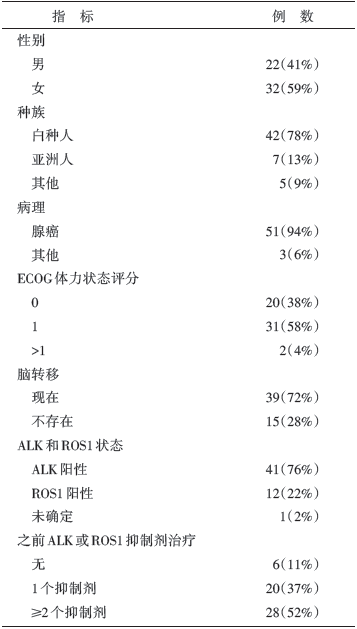
54名患者接受了至少一个剂量的劳拉替尼治疗, 这些患者包括41名(77%)ALK阳性和12名(23%)ROS1阳性的NSCLC, 1名患者ALK和ROS1状态未确定。28名(52%)患者接受过≥ 2种的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗, 39名(72%)患者有中枢神经系统转移。患者的平均年龄为52岁, 中位年龄50岁。基线时患者的一般特征见表1。
| 表1 基线时患者的一般特征 |
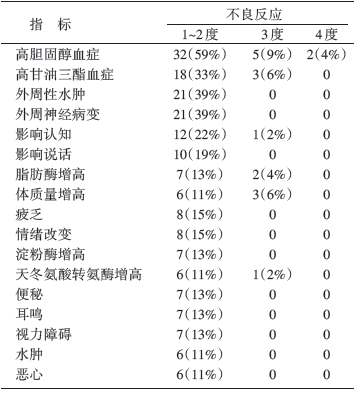
54名患者中最常见的治疗相关性不良事件为高胆固醇血症[72%(39/54)]、高甘油三酯血症[39%(21/54)]、外周神经病变[39%(21/54)]以及外周水肿 [39%(21/54)]。患者常见的治疗相关的不良反应见表2。
| 表2 患者常见的治疗相关的不良反应 |
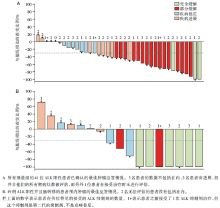
200 mg剂量组出现1例剂量限制性毒性(由于研究药物的毒性, 该患者在1周期的21次处方总剂量中至少有16次未服用, 毒性为2级神经认知不良事件, 表现有说话变慢、反应慢以及词汇提取困难)。没有发现最大耐受剂量。推荐给Ⅱ 期试验的剂量选定为100 mg, 每天1次。对于ALK阳性患者, 获得客观缓解患者的比例为46%(19/41); 对于接受过≥ 2种TKI治疗的患者, 客观缓解患者的比例为42%(11/26)。ALK阳性NSCLC患者的肿瘤对劳拉替尼的反应情况(见图1)。
在包括7名既往克唑替尼治疗过的ROS1阳性患者中, 12名患者中有6名(50%)获得客观缓解(95%置信区间21%~79%)。
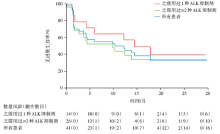
53例阳性患者的中位随访时间为17.4个月(95%置信区间16.1~22.1个月, 四分位数间距15.6~23.2个月)。53例患者中有19例患者的数据删失, 其余患者的可估计的中位无进展生存期(progression free survival, PFS)为9.6个月。41例ALK阳性患者的中位PFS为9.6个月(95%置信区间3.4~16.6个月)。其中, 14例ALK阳性患者之前接受过1种ALK抑制剂治疗, 他们的中位PFS 13.5个月(95%置信区间1.6个月~未评估)。26例ALK阳性且之前接受过≥ 2种不同ALK抑制剂治疗患者的中位PFS为9.2个月 (1.5个月~未评估) , 见图2。12例ROS1阳性患者的中位PFS为7个月(95%置信区间1.4~13.9个月)。
为了进一步探究经过第二代ALK抑制剂治疗失败患者的ALK突变情况是否与劳拉替尼响应有相关性, 本研究对12例经过至少1种第二代ALK抑制剂治疗失败的患者在劳拉替尼之前的标本进行回顾性分析。8例患者具有ALK激酶区域的突变。这8例患者的肿瘤经劳拉替尼治疗后有所缩小。没有ALK突变的患者对劳拉替尼没有应答。具有ALK耐药突变的患者比没有突变的患者对劳拉替尼响应的持续时间更长, 两者的平均天数分别为448天和42天, 两者的差异有统计学意义(P=0.027)。
在这项Ⅰ 期、剂量递增研究中, 对于晚期ALK阳性或ROS1阳性、大多数有中枢神经系统转移且既往有≥ 2种酪氨酸激酶抑制剂治疗失败的NSCLC患者中, 劳拉替尼显示出全身及颅内均有活性, 因此, 对于ALK阳性NSCLC患者, 对目前现有的TKI, 包括二代ALK TKI耐药后, 劳拉替尼可能是一种有效的治疗策略。
在这项国际、多中心、非盲、单臂、首次用于人体的Ⅰ 期剂量递增研究中, 劳拉替尼作为一种强效、高选择性和大脑渗透能力强的第三代ALK和ROS1抑制剂, 对经治的ALK或ROS1阳性NSCLC患者显示抗肿瘤活性。
目前, ALK阳性NSCLC患者的标准一线治疗方案为克唑替尼。第二代ALK抑制剂, 比色瑞替尼、艾乐替尼、布加替尼更有效。之前的研究表明, 大多数克唑替尼耐药的肿瘤仍依赖ALK通路活化, 更有效的抑制剂能克服克唑替尼耐药[8]。劳拉替尼在生物化学和细胞的实验中比第二代ALK抑制剂更有效[7]。在本研究中, 42%(11/26)第一代和第二代ALK抑制剂治疗过的患者对劳拉替尼有疗效, 平均有效持续时间为11.7个月。因此, 即使经历第二代ALK抑制剂治疗失败, 有相当比例的ALK阳性患者仍保持ALK通路活化, 更有效的抑制剂仍能使他们获益。50%对第二代抑制剂耐药的肿瘤是因为发生ALK的二次突变, 而最常见的是ALK G1202R[8]。临床前研究表明, 劳拉替尼对所有的ALK耐药点突变有效[9]。本研究回顾性地分析12例患者在劳拉替尼治疗前的标本, 发现8例患者具有ALK的耐药突变, 其中4例是ALK G1202R, 这8例患者能从劳拉替尼获益。而另外4例ALK点突变野生型患者的肿瘤经劳拉替尼治疗后没有缩小。但本研究的样本量小, 需要更大样本量的研究去证实经历第二代ALK抑制剂治疗失败后携带ALK的耐药突变的患者是否更容易对劳拉替尼有效。
因为血脑屏障, 中枢神经系统复发转移是ALK阳性患者的难治问题。本研究中, 19例患者在劳拉替尼治疗之前确诊有脑部转移, 其中8例在治疗后表现出颅内疗效。60%(3/5)治疗前有脑转移的ROS1阳性患者脑部病灶经治疗后有所缩小。本研究分析发现, 4例患者具有血浆和脑脊液的配对标本, 劳拉替尼在脑脊液相比血浆的浓度比例仅为0.75, 而克唑替尼在脑脊液相比血浆的浓度比例只有0.03, 劳拉替尼能很好地透过血脑屏障, 更有效地控制脑部病灶。但本研究中有部分患者经过了脑部放疗, 我们难以排除放疗对脑部控制的影响。
毒副作用方面, 劳拉替尼总体上耐受性良好, 主要表现为1~2度的不良反应。劳拉替尼的部分副作用与其他ALK抑制剂上相似, 比如外周水肿、体质量增加、便秘等。然而, 高胆固醇血症和高甘油三酯血症是劳拉替尼最常见的不良反应, 这点比较特别。再者, 四分之一的患者接受劳拉替尼治疗后出现神经认知的副作用, 包括多任务处理困难、说话速度慢、记忆力减退。另外, 15%患者表现为情绪不稳定。通过药物减量或中断后, 神经认知和情绪上的副作用可改善或逆转。
总体而言, 本研究给ALK阳性患者提供了更多治疗的可能, 强调了需要充分探索更有效的抑制剂去克服耐药性。本研究证实了劳拉替尼的安全性, 显示出了初步的抗肿瘤优越性。大部分经历了第二代ALK抑制剂治疗失败的患者仍能从劳拉替尼中获益。序贯的多线ALK抑制剂治疗无疑大大提高了ALK阳性的患者的总生存率。最近有研究表明, 第二代ALK抑制剂一线治疗比序贯的第一、二代抑制剂治疗疗效更佳[10]。目前有一项Ⅲ 期随机对照临床试验对劳拉替尼和克唑替尼加以比较。我们拭目以待劳拉替尼一线治疗ALK阳性NSCLC患者的疗效。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|