作者简介:

张会来,肿瘤学博士,主任医师,硕士研究生导师,现任天津医科大学肿瘤医院淋巴瘤科主任。主要学术兼职:中国抗癌协会淋巴瘤专业委员会常委、中国临床肿瘤学会(CSCO)抗淋巴瘤联盟常务委员、天津市抗癌协会淋巴瘤专业委员会主任委员。其它社会兼职:中国抗癌协会临床化疗专业委员会青年委员、中国老年肿瘤学会淋巴血液肿瘤委员会委员等。曾于2008年受瑞士政府合作发展基金资助赴南瑞士肿瘤研究所(IOSI)在国际著名淋巴瘤专家Franco Cavalli教授指导下从事恶性淋巴瘤的基础和临床研究,2012年赴美国Moffitt Cancer Center接受国际临床试验(IVSP)项目培训。以第一作者或通讯作者在《Blood》、《Medical Oncology》、《Leukemia & Lymphoma》、《Oncotarget》等国内外专业杂志上发表学术论文四十余篇。主持和参与多项国家自然科学基金、国家肿瘤临床医学研究中心项目、MD安德森姊妹医院国际合作项目、天津市科委、天津市卫生计生委和天津医科大学科研项目等。先后获得第二十二届亚太抗癌大会Young Investigator Award,天津市科技进步二等奖1项和三等奖2项。从事肿瘤内科临床工作20年,专注于恶性淋巴瘤的分子诊断及个体化治疗。
Ferreri AJM, Cwynarski K, Pulczynski E, et al. Chemoimmunotherapy with Methotrexate, Cytarabine, Thiotepa, and Rituximab (MATRix regimen) in patients with primary CNS lymphoma: Results of the first randomisation of the International Extranodal Lymphoma Study Group-32(IELSG32) phase 2 trial[J]. Lancet Haematol, 2016, 3(5):e217-e227.
1b。
• 原发中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)对化疗和放疗都很敏感, 但是由于血脑屏障的存在, 使很多化疗药物不能进入中枢, 常规化疗的疗效较差。
• 目前尚无标准治疗方案, 临床上通常采用以大剂量甲氨蝶呤为主的化疗联合全脑放疗(whole-brain radiotherapy, WBRT)为主要手段, 但患者的缓解持续时间通常较短。
• 有研究表明甲氨蝶呤-阿糖胞苷联合化疗方案的疗效较甲氨蝶呤单药明显提高。
• 利妥昔单抗是CD20单克隆抗体, 既往的小规模研究表明, 应用利妥昔单抗可提高PCNSL患者的疗效。
• 塞替哌对侵袭性淋巴瘤有效, 且易通过血脑屏障, 与抗代谢药物同用可增加其疗效。目前有多项研究表明含塞替哌的大剂量化疗(high-dose therapy, HDT)联合自体干细胞移植(autologous stem cell transplantation, ASCT)对于PCNSL患者具有很好疗效及耐受性。
• 有必要探讨新的治疗方案, 以提高疗效和对放疗的耐受性, 甚至进一步考虑替代WBRT的可行性。
评价甲氨蝶呤、阿糖胞苷、塞替哌联合利妥昔单抗(MATRix方案)治疗初治≤ 70岁PCNSL患者的疗效和安全性。
• 研究条件:欧洲5个国家的53个医学中心参与。
• 研究起止时间:2010年2月至2014年8月。
• 研究方法:多中心、开放性、随机对照Ⅱ 期临床研究(在治疗过程中有2次随机分组)。
• 研究对象:
入组标准:病理学证实为B细胞非霍奇金淋巴瘤初治患者, 疾病只局限于中枢神经系统、颅神经和/或眼睛; 年龄在18~70岁; 有可测量的病灶; ECOG评分≤ 3(对于66~70岁患者, ECOG评分≤ 2)。所有患者均签署知情同意书。
排除标准:既往有接受器官移植, 接受免疫抑制剂治疗, 乙肝病毒、丙型肝炎病毒、艾滋病病毒感染, 其他恶性肿瘤。
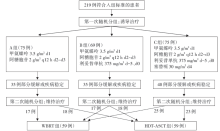
• 干预措施:研究分诱导缓解治疗和维持治疗两个阶段, 诱导治疗有效的患者经过再次随机分组接受不同的维持治疗。流程图见图1。
• 评价指标:主要终点指标为完全缓解率(complete remission rate, CRR)和2年无进展生存率(progression-free survival, PFS); 次要终点指标为总生存率(overall survival, OS)和安全性。
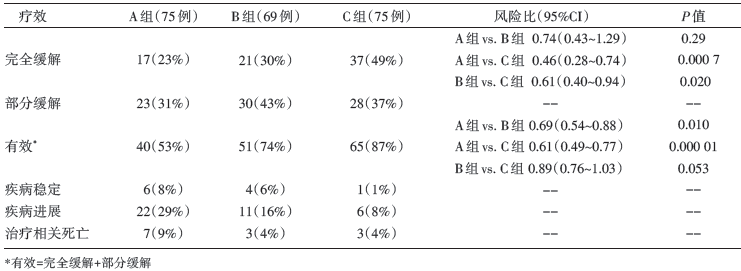
共入组227例患者, 可评价病例219例, 中位随访30个月(12~66个月)。甲氨蝶呤-阿糖胞苷治疗组(A组)患者的CRR是23%[95%可信区间(confidence interval, CI) 14%~31%]; 甲氨蝶呤-阿糖胞苷+利妥昔单抗治疗组(B组)患者的CRR是30%(95%CI 21%~42%); 甲氨蝶呤-阿糖胞苷+利妥昔单抗+塞替哌治疗组(MATRix方案, C组)患者的CRR是49%(95%CI 38%~60%)。具体详见表1。2年 PFS分别为:A组36%(95%CI 31%~41% ); B组46%(95%CI 40%~52%); C组61%(95%CI 55%~67%)。MATRix方案有较高的CRR和2年PFS。三组中最常见的3~4级副反应为中性粒细胞减少、血小板减少、贫血、粒细胞减少性发热或感染。4度血液学毒性多见于MATRix方案组, 但是三组患者的感染发生率相似。治疗相关死亡患者有13例(6%)。
| 表1 中位随访30 个月时各组的疗效 |
尽管IELSG32仅为Ⅱ 期随机临床研究, 中期数据分析结果表明:对于≤ 70岁的初治的PCNSL患者, MATRix方案较甲氨蝶呤-阿糖胞苷方案的完全缓解率明显增高, 并且具有良好的耐受性, 此方案可以作为后续研究的对照治疗方案。
PCNSL是一种高侵袭性疾病, 多见于老年患者, 男性多于女性, 中位发病年龄60岁[1, 2]。本病主要累及大脑、脊髓、眼睛、脑膜和颅神经, 全身少见。据统计, PCNSL大约占中枢神经系统肿瘤的 3%, 在非霍奇金淋巴瘤患者的比例可达1%。流行病学数据显示, 1960-1995年的发病率持续上升; 在上世纪90年代后期, 在发达国家, 特别是年轻艾滋病患者中, 其发病率有所下降。相比之下, 老年患者的发病率继续上升。大多数PCNSL的组织学为弥漫大B细胞淋巴瘤。PCNSL对化疗和放疗都很敏感, 但是由于血脑屏障的存在, 使很多化疗药物不能进入中枢, 常规化疗疗效较差。
PCNSL目前尚无标准治疗方案, 临床上通常采用以大剂量甲氨蝶呤为主的化疗联合WBRT为主要手段, 但患者的缓解持续时间通常较短, 且延迟神经毒性作用较大。对于没有接受巩固放疗的患者, 特别是年轻患者, 常规化疗后给予HDT联合ASCT是疗效最佳的方案。因此, 如何提高化疗疗效、降低复发及毒副作用是目前PCNSL治疗的研究热点。
截至目前, 该研究是针对初治PCNSL样本量最大的多中心随机研究, 同时也是第一个明确指出患者通过该诱导治疗总生存可获益的临床研究。该研究设计合理, 特别在诱导治疗及巩固治疗两个阶段分别进行随机分组, 以保证结果的可靠性。可评价病例有219例, 中位随访30个月(12~66个月)。MATRix方案组(75例)患者的CRR高达49%, 2年 PFS达到61%。虽然是甲氨蝶呤、阿糖胞苷、利妥昔单抗和塞替哌四药联合较两药或三药联合方案用药后4度血液学毒性发生率增加, 但是由于骨髓抑制导致感染的比例并未增加。MATRix方案可以考虑作为年轻初治PCNSL患者的一线诱导治疗方案。但是我们也要看到, 这个诱导方案的血液学毒性比较明显, 在临床应用时应该注意针对我国患者的体质进行相应的减量, 并且预防性地给予粒细胞集落刺激因子支持治疗。
2017年11月, 该研究组在《Lancet Haematol》上发表了此研究巩固治疗(第二次随机)的随访结果[3]:患者随机分为WBRT组和HDT-ASCT组, 每组均59例; 2年PFS分别为80%(95%CI 70%~90%)和 69%(95%CI 59%~79%)(风险比1.50, 95%CI 0.83~2.71, P=0.17), 两组的PFS无显著性差异。血液学毒性主要出现在HDT-ASCT组, 4度非血液学毒性少见, 相关死亡患者2例, 均出现在HDT-ASCT组。此研究针对巩固治疗的结论是WBRT和HDT-ASCT作为含大剂量甲氨蝶呤诱导治疗后的巩固治疗均有效, 疗效无明显差异。但是在选择治疗方案时应注意WBRT的认知障碍风险。
同期, Scordo 等[4]在2017年回顾性分析应用TBC(塞替哌+白消安+环磷酰胺)预处理方案后予HDT-ASCT 治疗43例原发和继发PCNSL患者疗效, 结果显示, ASCT后中位随访20个月, 患者1年PFS、 OS分别为83%和87%。德国研究组结果同样表明含塞替哌的HDT-ASCT治疗方案对复发/难治的PCNSL患者有效[5]。DeFilipp 等[6]2017年发表的一篇针对46例PCNSL患者达第一次完全缓解后进行TBC(塞替哌+白消安+环磷酰胺)联合HDT-ASCT治疗的回顾性分析表明, 移植后中位随访2.7年(6个月~7.5年), 2年OS和PFS 分别为95% (95%CI 80%~99%) 和92% (95%CI 77%~97%)。此结果初步提示对于第一次完全缓解的PCNSL患者可考虑TBC联合HDT-ASCT治疗, 从而进一步提高疗效和降低复发风险。这些研究提示含塞替哌的HDT-ASCT治疗在PCNSL的治疗有一席之地。
另外, Kuitunen 等[7]回顾性分析了BBBD(blood-brain barrier disruption)方案联合HDT-ASCT 一线或二线治疗PCNSL患者的疗效。中位随访15个月, 结果显示疗效显著。19例 (共25例, 76%) 患者达到完全缓解。 2年PFS和OS分别为61% 和 57% , 5年 OS 47%。其中一线接受5药联合的BBBD方案(利妥昔单抗, 甲氨蝶呤, 卡铂, 地塞米松, 阿糖胞苷, 环磷酰胺, 依托泊苷)的患者受益最高, CRR高达100%(共6例患者) ; 10例复发患者的CRR则为60%。PRIMAIN的多中心单臂研究结果提示[8], 对于≥ 65岁的初治PCNSL患者分别给予R-MPL(利妥昔单抗+甲氨蝶呤+甲基苄肼+洛莫司丁)和R-MP治疗, 全部患者的2年 PFS 37.3%(R-MP组34.9%, R-MPL组38.8%), 2年OS 47.0%(R-MP组47.7%, R-MPL组46.0%), 两种治疗方案疗效相似。R-MP组3 度及以上毒性发生率较低(71.1% vs. 87.0%)。这些研究进一步为我们提供了更多的可选择的方案。
最后, 值得一提的是, 北京天坛医院2017发表在《Oncotarget》的回顾性研究指出[9], RMAD(利妥昔单抗+甲氨蝶呤+阿糖胞苷+地塞米松)治疗初治PCNSL患者的CRR为66.7%(24/36), MAD组仅为33.3%(8/24)(P =0.011)。多因素分析表明应用利妥昔单抗治疗可延长患者的无进展生存期(P=0.005), 但是对OS 无影响。需要指出的是MAD方案中阿糖胞苷的剂量降至0.5~1 g/m2, 并且仅在第2天给予。这为中国患者的治疗提供了一定的依据及参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|