作者简介:

周辉,肿瘤学博士、生物学博士后,教授、主任医师、硕士研究生导师,Tel:0731-89762280,E-mail:zhouhui9403@126.com.湖南省肿瘤医院淋巴瘤血液内科主任,现任湖南省抗癌协会淋巴瘤专业委员会主任委员,湖南省抗癌协会肿瘤转移专业委员会副主任委员,CSCO抗淋巴瘤联盟委员,中国抗癌协会青年理事会理事,湖南省医师协会理事,湖南省医学会肿瘤化疗专业委员会委员,湖南省免疫学专业委员会常务理事,湖南省免疫学会青年委员会主任委员,湖南省抗癌协会肿瘤重症医学专业委员会常务委员及《现代生物医学进展》杂志常务编委,一直从事肿瘤内科临床工作,主要开展淋巴瘤、多发性骨髓瘤、肺癌、乳腺癌、食管癌、纵隔肿瘤等胸部恶性肿瘤的化疗、内分泌治疗、靶向治疗,主持湖南省自然科学基金等10项课题,为《肿瘤药学》等国内医学杂志的审稿人,以第一作者或通讯作者身份发表SCI、CSCD收录论文30余篇,其中有8篇被SCI收录,并获得湖南省医学优秀学术论文二等奖和优秀学术论文三等奖、长沙市科学技术医学学术年会优秀学术论文一等奖、湖南省医学科技奖三等奖,获得授权专利5项(其中发明专利1项)。
Kansara R, Shenkier TN, Connors JM, et al.Rituximab with high-dose Methotrexate in primary central nervous system lymphoma[J]. Am J Hematol, 2015, 90(12):1149-1154.
2a。
• 原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)95%以上的病理类型为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)。PCNSL的预后较系统性DLBCL差。PCNSL目前仍无标准的治疗方案, 一线治疗主要是以大剂量甲氨蝶呤(high-dose Methotrexate, HDMTX)为基础的联合化疗± 全脑放疗(whole brain radiotherapy, WBRT)。
• 利妥昔单抗(Rituximab)加入化疗后显著改善了系统性DLBCL患者的总体预后, 但利妥昔单抗穿透血脑屏障的能力较差, 目前利妥昔单抗对PCNSL预后的影响尚不明确。
比较HDMTX单药和利妥昔单抗联合HDMTX方案治疗PCNSL患者的生存结果, 评估利妥昔单抗对PCNSL预后的影响。
• 研究条件:加拿大英属哥伦比亚癌症研究所淋巴瘤数据库(BCCA)的患者临床资料, 时间为2000-2013年。
• 研究方法:回顾性、单中心、非随机临床研究。
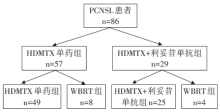
• 研究对象:86例患者入组。入组标准:病理学诊断为原发性中枢神经系统弥漫大B细胞淋巴瘤, 年龄> 16岁, 至少接受过1周期HDMTX± 利妥昔单抗治疗, 一线治疗不含放疗, 肌酐清除率> 60 mL/min。排除标准:未经病理证实的PCNSL, 病理诊断为非DLBCL亚型, 人类免疫缺陷病毒感染, 系统性淋巴瘤。
• 干预措施:
(1) HDMTX单药组:2000年1月至2006年11月, 患者一线接受HDMTX单药化疗, 具体剂量为:甲氨蝶呤8 g/m2静脉滴注4小时, HDMTX结束后24小时开始口服亚叶酸钙25 mg, 每6小时1次, 直至血中甲氨蝶呤< 0.1 μ mol/L, 每2周为1周期, 治疗4个周期后, 采用脑部CT/MRI评价疗效, 若疗效为完全缓解(complete response, CR), 则继续接受2周期HDMTX治疗(至少6周期); 若疗效为部分缓解(partial response, PR)或疾病稳定(stable diseasse, SD), 则继续HDMTX化疗(取得最佳疗效后再额外增加2周期, 最多为10周期), 若患者出现治疗相关毒性反应而早期中断HDMTX或疗效为疾病进展(progressive disease, PD), 则采用WBRT挽救治疗。
(2)HDMTX+利妥昔单抗组:2006年12月至2013年12月, 患者一线接受HDMTX+利妥昔单抗治疗, HDMTX的剂量和用法同HDMTX单药组。利妥昔单抗的剂量及用法: 375 mg/m2, d1或d2, 每2周为1周期, 总共4周期。治疗4个周期后, 采用脑部CT/MRI评价疗效, 若疗效为CR, 则继续接受2周期HDMTX治疗(至少6周期), 若疗效为PR或SD, 则继续HDMTX化疗(取得最佳疗效后再额外增加2周期, 最多为10周期), 若患者出现治疗相关毒性反应而早期中断HDMTX或疗效为PD, 则采用WBRT挽救治疗。
• 评价指标:主要终点指标为无进展生存时间(progress-free survival, PFS), 次要终点指标为总生存时间(overall survival, OS)。
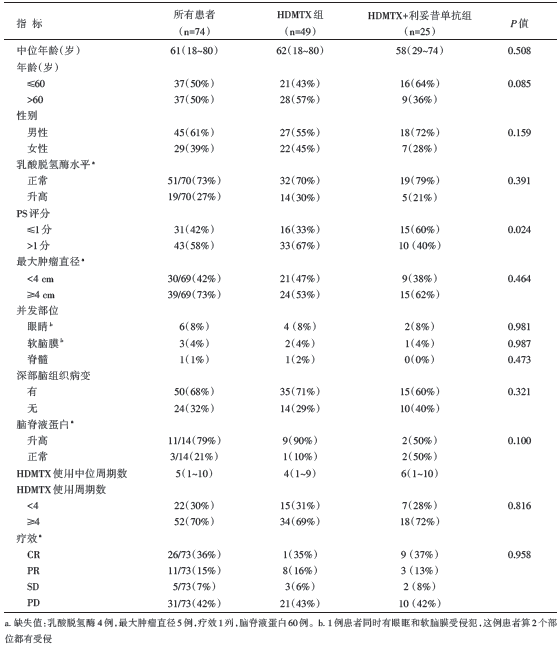
共入组86例患者, 其中12例(HDMTX单药组8例, HDMTX+利妥昔单抗组4例)因无法耐受HDMTX化疗毒性而早期中断HDMTX化疗, 随后接受了WBRT, 这12例患者被排除后, 最终符合入组标准的病例为74例(HDMTX单药组49例, HDMTX+利妥昔单抗组25例, 详见图1), 患者基线特征详见表1, 总的中位随访时间为5年(0.5~13.5年), HDMTX单药组的中位随访时间为8.8年(3.2~13.5年), HDMTX+利妥昔单抗组的中位随访时间为1.9年(0.6~7.3年)。
全组患者的5年无进展生存率和总生存率分别为17%和38%, 中位PFS和OS分别为5个月和38个月。HDMTX+利妥昔单抗组较HDMTX单药组, 在PFS(风险比 0.75, 95%可信区间 0.41~1.35, P=0.33)及OS(风险比 0.73, 95%可信区间 0.35~1.52, P=0.39)方面差异并无统计学意义。全组患者的完全缓解率为36%, HDMTX单药组和HDMTX+利妥昔单抗组患者的完全缓解率分别为35%和37%(P=0.958)。
| 表1 患者的基线特征 |
利妥昔单抗联合HDMTX相比HDMTX单药并不会改善PCNSL患者的PFS及OS。
PCNSL是结外淋巴瘤的一个独特亚型, 主要侵犯脑实质、眼、脊髓、软脑膜, 而常无全身受累的表现。PCNSL约占非霍奇金淋巴瘤的2%~3%, , 约占中枢神经系统( central nervous system, CNS)恶性肿瘤的2.6%。确诊时中位年龄为 65 岁。90%以上的病理亚型为DLBCL, 具有侵袭性强、疗效差、死亡率高、易复发等显著特征。尽管全身化疗、鞘内化疗加WBRT的综合治疗模式提高了PCNSL的疗效, 延长了OS, 但PCNSL总体预后仍较差, 中位OS仅为17~45个月, 仍然需要探索更为有效的治疗药物。PCNSL目前的标准一线化疗方案尚未确定, 主要是以HDMTX(MTX≥ 3 g/m2)为基础的联合化疗[1], 但与甲氨蝶呤联合的最佳药物尚未明确, 可联合的化疗药物包括替莫唑胺、阿糖胞苷和塞替哌等。
利妥昔单抗是一种人鼠嵌合性单克隆抗体, 能特异性地与B淋巴细胞跨膜抗原CD20 结合。95%以上的B 细胞性非霍奇金淋巴瘤的肿瘤细胞表达CD20。利妥昔单抗与B 细胞上的CD20 抗原结合后, 启动介导B 细胞溶解的免疫反应, 从而直接诱导细胞凋亡。利妥昔单抗加入到已有的化疗方案后极大程度上改善了系统性DLBCL患者的长期生存及预后, 然而利妥昔单抗属于大分子物质, 难以透过正常的血脑屏障, 其在脑脊液的浓度仅为外周血药物浓度的0.1%, 利妥昔单抗加入到HDMTX能否改善 PCNSL的生存结果尚不知晓。
临床前的研究数据表明, 在CNS恶性肿瘤中血脑屏障可能被破坏, 且此前的一项回顾性研究(NABTT)显示, 利妥昔单抗单药治疗12例HDMTX治疗后的复发/难治性PCNSL, 有效率高达42%[2]。此外几个回顾性的小样本临床研究也显示, 利妥昔单抗加入HDMTX为基础的化疗方案后可能改善PCNSL的预后[3, 4, 5]。正是基于此, 来自于加拿大英属哥伦比亚肿瘤研究所的学者们试图通过本项回顾性、单中心、非随机、历史对照组研究回答上述问题 [6]。然而非常令人遗憾, 结果显示利妥昔单抗联合HDMTX相比历史对照组的HDMTX单药方案并未改善PCNSL患者的生存结果。
该研究设计虽是回顾性的, 但也有其可取、合理之处。①所有患者均经过了中心病理复核, 保证了诊断的准确性。②该研究虽为单中心的病例分析, 但总的样本量为86例, 最终符合入组标准的患者也有74例, 鉴于PCNSL发病率非常低, 这一样本量相对不算小。③该研究虽为回顾性分析, 但除ECOG PS评分外, 两组其余的基线特征都比较均衡, 排除了基线不均衡对预后的影响。④该研究虽为回顾性的, 但是两组患者的一线治疗方案相对统一, 化疗方案均为单药HDMTX, 且两组的HDMTX剂量密度相同, 此外两组所有患者均未接受WBRT作为一线巩固治疗, 从而避免了治疗方案的异质性对生存结果的干扰。综上所述, 该研究的结论具有一定的临床指导意义。
同时, 该研究同样存在着一些局限性:①为回顾性、非随机对照、单中心的研究; ②HDMTX+利妥昔单抗组样本量相对较少(只有25例), ③HDMTX+利妥昔单抗组总体随访时间较短(中位随访时间23个月), 随着随访时间的延长, 可能两组的PFS和OS曲线将会拉开并导致差异有统计学意义。④利妥昔单抗使用的周期数偏少, 只有4周期, 而不是系统性DLBCL常用的6~8周期, 利妥昔单抗疗程的不足可能也是导致两组生存结果无差异的原因之一。
评估利妥昔单抗在PCNSL治疗价值的前瞻性、随机对照临床研究鲜有报道, 目前已报道研究结果的两项研究为IELSG-32研究和HOVON 105 PCNSL/ALLG NHL24协作研究。IELSG-32研究将患者随机分为三组, A组为HDMTX+阿糖胞苷, B组为HDMTX+阿糖胞苷+利妥昔单抗, C组为HDMTX+阿糖胞苷+塞替哌+利妥昔单抗。4周期后疗效评价为CR/PR或SD的患者随机分为WBRT或自体造血干细胞移植巩固治疗两组。结果显示A组患者的客观有效率(objective response rate, ORR)为53%, 完全缓解率为23%; B组的ORR为74%, 完全缓解率为30%; C组的ORR为87%, CR率为49%。中位随访30个月后, A、B、C三组的2年无进展生存率分别为36%、46%、61%, 上述结果显示利妥昔单抗加入到HDMTX为基础的化疗后, 无论是近期有效率还是远期生存均显著改善[7]。HOVON 105 PCNSL/ALLG NHL24研究将PCNSL患者随机分为两组, 一组为MBVP (甲氨蝶呤+卡莫司汀+替尼泊苷+泼尼松), 另一组为MBVP+利妥昔单抗, 2周期化疗后疗效为CR或PR的患者接受大剂量阿糖胞苷化疗1周期, 随后对≤ 60岁的患者行WBRT。与ESLG-32研究的结果相反, HOVON 105 PCNSL/ALLG NHL24研究显示利妥昔单抗的加入并未明显改善患者的ORR、无事件生存期、PFS和OS[8], 这一结果与前述BCCA的回顾性分析结果相吻合。
综上所述, PCNSL目前尚未有标准的一线化疗方案, 循证医学证据最多的仍然是HDMTX为基础的联合化疗方案, 利妥昔单抗的加入能否改善PCNSL的近期疗效及远期生存结果, 尚缺乏高级别的循证医学证据, 其在PCNSL的应用价值还需要更多前瞻性、多中心、随机对照的大样本临床研究来证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|