作者简介: 张惠博(1992-),男,甘肃陇西人,硕士研究生,研究方向为肿瘤的放化疗。
目的 评价亚甲基四氢叶酸还原酶C677T基因多态性与晚期结直肠癌患者氟尿嘧啶为基础化疗疗效的相关性。方法 计算机检索PubMed、CNKI、Cochrane图书馆、EMBASE数据库,筛选关于亚甲基四氢叶酸还原酶C677T基因多态性与晚期结直肠癌患者氟尿嘧啶联合化疗疗效相关性的队列研究或病例对照研究。检索时限为数据库建库至2017年3月27日。获取相关数据,并评价纳入研究质量,使用RevMan5.3软件进行统计学分析。结果 共纳入文献19篇。Meta分析结果显示:①亚甲基四氢叶酸还原酶C677T基因突变型患者(677CT和677TT)与野生型(677CC)相比,氟尿嘧啶联合化疗的疗效无显著性差异,合并比值比为1.06(95%可信区间0.71~1.58,P=0.77),亚组分析提示氟尿嘧啶联合化疗与单药化疗亚组,亚甲基四氢叶酸还原酶多态性与化疗的生存获益无相关性。② C677T突变型与野生型相比,生存风险比无显著性差异,合并风险比为1.05(95%可信区间0.93~1.18,P=0.42)。③亚甲基四氢叶酸还原酶C677T基因多态性与患者氟尿嘧啶联合化疗3~4级毒性无显著差异,合并比值比为0.88(95%可信区间0.74~1.05,P=0.16)。结论 亚甲基四氢叶酸还原酶 C677T基因多态性与晚期结直肠癌患者对氟尿嘧啶联合化疗的疗效及毒性无明显相关性。纳入研究的数量及质量有限,仍需更多高质量、大样本的病例对照研究或队列研究加以验证。
Objective To evaluate the association of MTHFR C677T polymorphism with the clinical outcomes and toxicities of 5-FU-based chemotherapy in advanced colorectal cancer and guide the clinical individualized treatment.Methods The PubMed database, EMBASE, Chinese National Knowledge Infrastructure, Cochrane Library were searched(up to March 27, 2017), screening cohort studies or case control studies about the association of MTHFR C677T polymorphism with the clinical outcomes and toxicities of 5-FU-based chemotherapy in advanced colorectal cancer according to inclusive and exclusive criteria, collecting the data and assessing the quality of researches, then meta-analysis was carried about by RevMan5.3.Results A total of 19 studies were included in the meta-analysis. The result showed no association between MTHFR C677T polymorphism and the clinical outcomes of Fluorouracil-based chemotherapy in advanced CRC patients. The pooled OR values for 677CT+677TT compared with 677CC was 1.06(95%CI 0.71~1.58,P=0.77). In the subgroup analysis by 5-FU mono therapy and combination therapy, no statistically differences were found. The pooled HR for death in patients with CT+TT was 1.05(95%CI 0.93~1.18,P=0.42). There is also no significant difference between MTHFR C677T polymorphism and grade 3~4 toxicity of chemotherapies, the OR values for CT+TT compared with CC was 0.88(95%CI 0.74~1.05,P=0.16).Conclusion The results of meta-analysis suggests there was no association of MTHFR C677T polymorphism with the clinical outcomes and toxicities of Fluorouracil-based chemotherapy in advanced CRC patients. Further studies are needed to validate the conclusion.
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一, 其发病率及死亡率均居世界前列[1, 2]。目前, 以氟尿嘧啶(Fluorouracil, 5-FU)为基础的联合化疗是晚期CRC的一线治疗方案, 然而疗效及毒性是临床密切关注的问题。近年来叶酸及其代谢酶的基因多态性与CRC关系的研究进入人们的视野, 包括CRC易感性、化疗疗效, 毒性及预后等。
叶酸参与核苷酸的合成和转化。亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase, MTHFR)是叶酸代谢的关键酶, 催化5, 10-亚甲基四氢叶酸(5, 10-MTHF)不可逆地转化为5-甲基四氢叶酸, 后者将同型半胱氨酸转化为蛋氨酸, 进而转化为S-腺苷甲硫氨酸(S-adenosylmethionine, SAM), 作为甲基供体广泛参与人体生化反应, 在细胞代谢中扮演重要角色。MTHFR基因最常见的多态位点为第4外显子的677位点[3], 此位点胞嘧啶C突变为胸腺嘧啶T(677C> T), 由缬氨酸取代丙氨酸, 使得MTHFR酶活性降低。5-FU在细胞内转化为氟尿嘧啶脱氧核苷酸(FdUMP), 与胸苷酸合成酶(thymidylate synthase, TS)及5, 10-MTHF形成三聚体, 抑制TS的功能, 阻止脱氧尿苷酸(dUMP)转化为脱氧胸苷酸(dTMP), 影响DNA的合成, 因此, MTHFR基因多态性与5-FU为基础的化疗有密切联系。有假说认为, 低活性MTHFR增加细胞内5, 10-MTHF的浓度, 增强了5-FU的细胞毒性作用[4]。近年来有许多对MTHFR基因多态性与5-FU化疗敏感性的研究, 但结果尚存在争议。本研究通过Meta分析, 对有关MTHFR C677T基因多态性与化疗敏感性及化疗毒性关系的研究进行综合评价, 以期为晚期CRC临床用药的选择和个体化治疗提供新的思考。
以PubMed、CNKI中文数据库、Cochrane图书馆、EMBASE数据库为文献检索的主要来源。检索时间均为建库至2017年3月27日。同时, 手工检索纳入文献的参考文献。
以PubMed为例, 英文检索词为:
#1 Methylene Tetrahydrofolate Reductase
#2 MTHFR
#3 #1 or #2
#4 colon cancer
#5 CRC
#6 colorectal cancer
#7 rectal cancer
#8 #4 or #5 or #6 or #7
#9 chemotherapy OR chemical therapy
#10 #3 and #8 and #9
以CNKI为例, 中文检索词为:
#1 亚甲基四氢叶酸还原酶 ORMTHFR
#2 大肠癌 OR直肠癌 OR结直肠癌
#2 化疗 OR化学治疗
1.2.1 文献纳入标准
①纳入文献资料已公开发表; ②研究对象为经病理活检确诊的晚期CRC; ③研究指标包括对MTHFR基因多态性与晚期CRC化疗敏感性、预后及化疗毒性的相关性; ④疗效评价标准为公认的WHO标准, 即以疾病完全缓解(complete remission, CR)+部分缓解(partial remission, PR)为化疗敏感性的评价指标, 毒性评估为3~4级化疗毒副反应的发生率; ⑤观察患者生存的文献, 以总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)为疾病预后评估指标, 并依据文献所提供的数据得出风险比(hazard ratio, HR)和95%置信区间(confidence interval, CI)。
1.2.2 文献排除标准
①对细胞系的研究; ②非晚期CRC(Ⅰ ~Ⅲ 期)的研究, 包括新辅助放化疗及术后放化疗的研究; ③针对化疗毒性分析, 无法计算纳入资料整体3~4级毒性反应发生率的研究; ④针对生存分析, 数据不充分或无生存曲线, 亦或无法依据现有资料计算HR及CI的研究; ⑤摘要或者综述。
资料提取由2名评价员根据检索词, 对每篇文献的题目和摘要进行筛查, 并通过讨论达成共识, 确定符合标准的文献。不一致的地方则通过第三位评价员参入讨论。内容包括纳入标准, 研究对象的基本资料, 各组间样本量、化疗方案、测量指标、统计学方法等。
文献质量评价由2名评价员依据队列研究的NOS偏倚风险评价标准, 从研究人群的选择、各组间的可比性、结果测量等方面评估, 如遇争议则由第三位评价员参入讨论。
阅读全文后提取资料, 录入的主要内容包括:①一般资料, 包括文献题目、摘要、作者、发表时间; ②研究对象基本特征, 包括地区、MTHFR基因型频率、样本量、化疗方案, 检测方法; ③提取信息:MTHFR野生型基因(677CC)、突变型基因(677CT以及677TT)的病例数、各自化疗敏感病例数, 3~4级化疗毒性反应发生率, OS, PFS, HR, 95%CI等。
Meta分析采用RevMan 5.3软件进行, 通过χ 2检验及I2检验进行纳入文献的异质性评价。若P≥ 0.1、I2≤ 50%, 则认为不存在异质性, 使用固定效应模型; 若P< 0.1、I2> 50%, 说明各研究之间存在异质性, 则采用随机效应模型分析, 并分析其异质性来源, 根据可能出现的异质性进行亚组分析。采用比值比(odds ratio, OR)及HR作为分析统计量, 所有分析均计算95%CI。
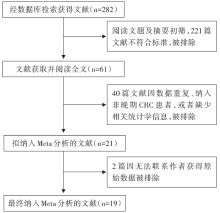
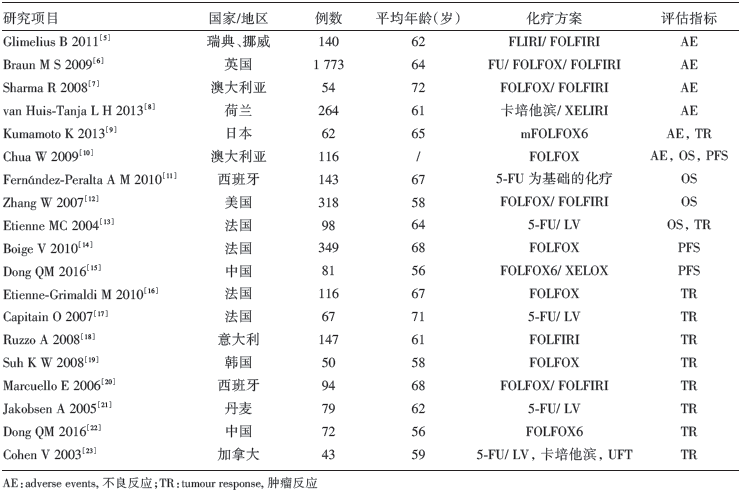
初检相关文献282篇, 其中英文245篇, 中文37篇。经阅读文题及摘要剔除不符合纳入标准的文献221篇。阅读全文及质量评价61篇, 依据评价指标, 无法获取原始数据并去重后共纳入19篇合格文献[5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23], 样本量47~1 601不等。文献筛选流程见图1, 纳入文献基本特征见表1。
| 表1 纳入文献的基本信息 |
依据队列研究的NOS偏倚风险评价标准, 总体来说暴露组人群选择恰当, 组间可比性好, 数据完整, 结果可靠, 整体纳入研究的质量良好。
2.3.1 MTHFR基因多态性与5-FU化疗敏感性分析
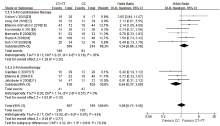
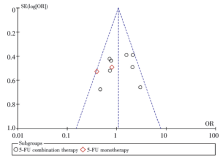
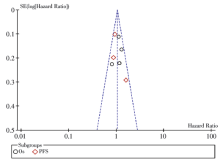
研究比较了晚期CRC患者以5-FU为基础化疗的疗效, 对5-FU联合化疗的客观反应率进行分析。共纳入文献10篇, 异质性检验, 结果显示χ 2=15.80, P=0.07, I2=43%, 研究间存在异质性, 用随机效应模型合并分析。对于MTHFR基因多态性, 突变型患者(677CT, 677TT)与野生型(677CC)患者用以5-FU为基础的联合化疗的疗效无显著差异, 合并OR值为1.06(95%CI 0.71~1.58, P=0.77), 见图2。亚组分析显示, 5-FU联合化疗与单药化疗亚组, MTHFR多态性与化疗的生存获益间无相关性, 而亚组间的化疗疗效有显著差异(P=0.04), 见图3。漏斗图提示无明显的发表偏倚, 见图4。纯合突变型TT与野生型CC及杂合突变型CT, 化疗疗效有显著性差异, 合并OR值为1.37(95%CI 0.91~2.06, P=0.13), 见图5; 纯合突变型TT与野生型CC的化疗疗效也无显著性差异, 合并OR值为1.40(95%CI 0.90~2.20, P=0.14), 见图6。
2.3.2 MTHFR基因多态性与5-FU化疗生存获益分析
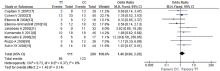
如图7所示, 生存分析共纳入6篇文献, 异质性检验结果显示χ 2=7.76, P=0.26, I2=23%, 结果间不存在异质性, 用固定效应模型合并分析。综合分析提示MTHFR基因多态性与5-FU为基础化疗的OS及PFS无显著相关性, HR值分别为1.12(95%CI 0.96~1.31, P=0.16)和0.97(95%CI 0.82~1.15, P=0.74)。生存分析合并HR值为1.05(95%CI 0.93~1.18, P=0.42)。漏斗图提示无显著发表偏倚, 如图8。
2.3.3 MTHFR基因多态性与5-FU化疗3~4级毒性分析
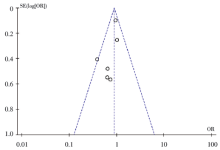
研究比较了晚期CRC患者5-FU为基础化疗的3~4级毒性, 共纳入文献6篇, 均采用5-FU联合化疗方案(FOLFOX/FOXFIRI)。纳入文献的异质性检验结果显示χ 2=5.53, P=0.35, I2=10%, 结果间不存在异质性, 用固定效应模型合并分析。如图9和图10所示, 研究提示MTHFR基因多态性与5-FU联合化疗的3~4级毒性无显著相关性, 合并OR值为0.88(95%CI 0.74~1.05, P=0.16)。对纳入文献进行发表偏倚评价, 漏斗图提示无显著的发表偏倚, 纳入总体的结果可靠, 见图11。
近年来许多研究提示MTHFR基因多态性与结直肠癌的发病率、相关抗肿瘤药物的疗效及预后存在相关性, 但是不同研究的结果存在差异。本研究试图通过Meta分析揭示MTHFR多态性与晚期CRC患者5-FU为基础化疗的相关性, 包括化疗敏感性、化疗毒性及预后。
FdUMP与TS及5, 10-MTHF形成三聚体, 抑制TS的功能, 阻止dUMP转化为dTMP, 进而影响DNA的合成, 是5-FU发挥抗肿瘤作用的主要机制。MTHFR基因677C> T使得MTHFR酶活性下降, 进而造成5, 10-MTHF细胞内堆积, 与FdUMP及TS结合增加5-FU的细胞毒副作用。因此, MTHFR基因多态性可能对5-FU为基础的化疗结局产生影响。
Etienne等[16]的研究表明, MTHFR 677C> T基因突变与FOLFOX化疗疗效有显著相关性。研究纳入117例晚期CRC患者, 均接受FOLFOX 7方案一线化疗6周期, 其中突变型(677CT+677TT)患者的临床获益率为59.7%(客观缓解+完全缓解), 野生型(677CC)为40.9%(P=0.042)。然而, 目前可获得的研究荟萃分析表明, MTHFR基因多态性与5-FU为基础的化疗疗效无显著相关性, 亚组分析显示无论是5-FU联合化疗还是单药治疗, MTHFR基因多态性对疗效的影响均无差异。值得注意的是, MTHFR基因多态性并非是影响5-FU耐药的唯一因素, 其他因素如TS基因高表达/TS基因突变[24]、MAPK信号通路[25]、microRNAs[26]以及其他蛋白如热休克蛋白27、黏蛋白等, 这些是MTHFR基因多态性无法克服的。
个体差异多态性很大程度上影响化疗的毒性反应, 这种多态性与单核苷酸多态性密切相关。MTHFR催化5, 10-MTHF的还原, 而5, 10-MTHF是参与5-FU抗肿瘤效应, 因此, MTHFR酶活性的降低可能增强5-FU的毒性。然而, Glimelius等[5]的研究发现, MTHFR基因突变型(CT+TT)降低了3~4级化疗毒性的发生率(OR 0.39, 95%CI 0.18~0.87, P=0.005), 此结论与假设截然相反, 且存在争议。Sharma等[7]同样发现纯和突变型(TT)降低3~4级毒性反应, 但研究纳入病例数少, 结论存在一定的偏差。排除非晚期CRC化疗的研究, 本次纳入分析的6篇研究显示MTHFR基因多态性与晚期CRC患者5-FU为基础的化疗3~4级毒性反应无显著相关性。
本次Meta分析亦未发现MTHFR基因多态性与晚期CRC患者5-FU化疗预后有相关性。导致这种结果的原因可能有:首先, MTHFR基因除了第4外显子第677位点的多态性, 第7外显子1298位点也存在多态性, 亦可以影响MTHFR活性而影响5-FU的抗肿瘤效应, 例如Ferná ndez等[11]研究发现1298位点突变患者预后差。其次, MTHFR是影响5-FU药理作用的众多蛋白之一, 可以与其他药物代谢基因如TS基因、DNA修复基因(ERCC)、谷胱甘肽-S-转移酶(GSTs)基因等共同影响5-FU的化疗疗效及预后, 使得患者对5-FU药理反应产生差异。另外, 药物在体内吸收、代谢过程甚至药物的剂量都会影响患者对化疗的敏感性。
本研究的不足之处主要有以下几个方面。首先, 纳入文献的样本量小, 异质性明显, 个别文献报道阳性结果不足以反映整体水平; 其次, 依据严格的纳入与排除标准, 排除了数据不完整或未能获得完整资料的文献, 或部分文献未直接提供HR, 以生存曲线计算的HR与原始数据可能存在出入, 均可能导致偏倚的发生。最后, 正如前文提到的, 晚期CRC患者5-FU化疗疗效及预后受多种因素的影响, 除了基因多态性外还有其他不可控的因素如种族、环境等。
本次Meta分析显示MTHFR C677T基因多态性与晚期CRC患者5-FU联合化疗反应(疗效与毒性)及生存获益无明显相关性。因纳入研究的数量及质量有限, 仍需更多高质量、大样本的病例对照研究或队列研究加以验证, 为晚期CRC患者个体化治疗提供新的思路。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|