作者简介:
 | 欧阳取长,湖南省肿瘤医院乳腺内科主任,主任医师,医学博士,硕士研究生导师。中国抗癌协会乳腺癌专业委员会委员,中国临床肿瘤学会乳腺癌专家委员会委员,中国医药教育协会乳腺疾病专业委员会常务委员,中国研究型医院学会乳腺专业委员会常务委员,中国研究型医院学会精准医学与肿瘤多学科综合治疗(MDT)专业委员会乳腺学组副组长,湖南省医学会肿瘤化疗专业委员会主任委员,湖南省医学会肿瘤化疗专业委员会乳腺癌学组组长,湖南省妇幼保健与优生优育协会妇科与乳腺肿瘤防治专业委员会主任委员,湖南省抗癌协会肿瘤化疗专业委员会副主任委员。 |
Proskurina AS, Gvozdeva TS, Alyamkina EA, et al. Results of multicenter double-blind placebo-controlled phase Ⅱ clinical trial of Panagen preparation to evaluate its leukostimulatory activity and formation of the adaptive immune response in patients with stage Ⅱ -Ⅳ breast cancer[J]. BMC Cancer, 2015, 15(1): 122.
1b。
肿瘤患者使用抗细胞增殖类药物时, 通常常规接受辅助药物以减少抗增殖药物的毒性作用, 尤其是对肝脏和造血细胞的毒副作用。目前, 刺激白细胞生长药物主要包括促进细胞代谢类药物(如Dicarbamin)和集落刺激生长因子类似物(如Neupogen)。近年来, 一类新型的依赖于核酸的白细胞刺激剂被引入临床。该类药物依赖于CpG调节的DNA单核苷酸, 可诱导获得性抗病毒及抗肿瘤的免疫应答。在小鼠实验中, 该类药物可抑制50%~60%肿瘤生长。依赖于人类双链DNA(dsDNA), Panagen是一个多功能的白细胞刺激剂。与化疗药物联用时, Panagen可保护和激活造血干细胞的增殖, 促进CD8+穿孔素+细胞毒T细胞的扩增并诱导适应性免疫的应答。不同于集落刺激因子, Panagen由耐消化道腐蚀外衣包裹制成口服片剂, 在多疗程化疗中长期服用, 可避免静脉给药致感染及双链DNA致自身免疫反应等风险。
在已接受3周期FAC或AC化疗后的Ⅱ ~Ⅳ 期乳腺癌患者中, 研究Panagen能否刺激患者造血功能、诱导继发性免疫反应及减少肿瘤复发风险。
• 研究条件: 俄罗斯科学院(Russian Academy of Science)Proskurina教授牵头, 俄罗斯卫生和社会发展部批准的研究项目(Clinical Trial.gov NCT02115984)。
• 研究时间: 2010-03-12至2014-04-07。
• 研究方法: 随机、双盲对照、Ⅱ 期临床研究。
• 研究对象: 高危Ⅱ 期乳腺癌患者或建议使用化疗的Ⅲ ~Ⅳ 期乳腺癌患者。
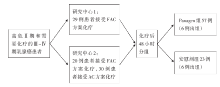
• 干预措施: 入组80例患者, 随机分为安慰剂组和Panagen组, 见图1。所有患者均接受3个疗程(3周方案)标准FAC方案(氟尿嘧啶 500 mg/m2+多柔比星 50 mg/m2+环磷酰胺 500 mg/m2第一天静脉给药), 或AC化疗方案(多柔比星 50 mg/m2+环磷酰胺 500 mg/m2第一天静脉给药)治疗。化疗后48小时, 患者开始每日服用Panagen片剂或安慰剂(5 mg× 6片, 即每天30 mg), 连续服用17天, 直至化疗后第20天(下一化疗疗程前一天)。如化疗被推迟, 患者仍继续服用Panagen剂或安慰剂, 直至下次化疗的前一天。
• 评价指标: 主要研究终点指标为化疗期间的白细胞减少症及中性粒细胞减少症的程度(分1~4级)。
• 该研究中Panagen制品是纯化的外源性细胞外dsDNA制成的片剂。该制品具有以下五个特性: ①无需转染过程, 可直接与各种细胞相互作用; ②口服片剂在肠道吸收后, 可直接整合到胃肠道的免疫活性细胞内, 刺激胃肠道的免疫活性细胞迁移到外周血中, 进而通过胞浆中的DNA传感器激活细胞因子; ③Panagen dsDNA与树突状细胞相互作用, 激活抗原呈递反应, 促进细胞毒穿孔素+CD8+T细胞的扩增; ④选择性地靶向CD34+造血干细胞; ⑤与环磷酰胺及多柔比星有协同作用。
• 与对照组患者相比, 使用Panagen制剂患者的白细胞、中性粒细胞、单核细胞及淋巴细胞的水平显著升高。三次化疗后, 对照组患者的白细胞、中性粒细胞、单核细胞及淋巴细胞水平明显降低, 而Panagen组的患者, 没有显著降低趋势, 仍保持化疗前水平。
• Panagen可激活适应性免疫应答, 在Panagen组中, 58%FAC方案和16%AC方案化疗患者显著升高外周血中CD8+穿孔素+细胞毒T细胞。对比对照组, Panagen组患者的外周血细胞毒指数(cytotoxic index of PBMCs)显著升高 (P< 0.05)。此外, Panagen dsDNA制品与环磷酰胺联合可使免疫应答放大, 显著升高外周血的细胞毒T细胞。
• 长期随访发现24% Panagen组和45%安慰剂组患者在化疗后3年内肿瘤复发。Panagen组复发患者的肿瘤进展多在化疗起始阶段。
Panagen可维持化疗患者的造血功能, 加强固有免疫细胞抵御连续化疗导致的细胞毒作用并可激活患者适应性免疫应答。作为一种多功能药物, Panagen可显著降低乳腺癌患者化疗后的3年复发率。
Panagen研究设计主要针对Ⅱ 期高风险和Ⅲ ~Ⅳ 期符合FAC或AC辅助化疗要求的乳腺癌患者, 在标准3周FAC或AC方案期间给予Panagen dsDNA口服片剂(每天30 mg)。方案为每2~3小时服用一次, 从前一个化疗疗程结束后48小时后开始连续服用至下一个化疗疗程前一天。安慰剂组在相同的时间给予相应安慰剂。
2010-2012年, Alymkina课题组先后在《Cell Immunology》上发表了三篇文章, 证实异源双链dsDNA可激活树突状细胞, 促进树突状细胞成熟, 刺激细胞因子产生, 刺激CD8+穿孔素+细胞毒性T细胞增殖, 抑制肿瘤细胞。采用人dsDNA片段, 使用抗胃肠腐蚀的外衣包裹, 制作成Panagen口服片剂。Panagen片剂可在长期连续性的化疗中与化疗药物配合使用, 没有感染和自身免疫反应等副作用。与粒细胞集落生长因子(granulocyte colony stimulating factor, G-CSF)类似物直接刺激造血干细胞释放入血不同, Panagen通过激活肠道黏膜内单核细胞分泌细胞因子, 诱导继发性免疫反应, 间接产生升白细胞的作用。
俄罗斯健康与社会发展部批准了Panagen在Ⅱ ~Ⅳ 期化疗的乳腺癌患者中开展Panagen dsDNA口服制剂的Ⅱ 期临床试验(ClinicalTrials.gov NCT02115984)。Alymkina课题组与两家医学中心(Irkutsk区域肿瘤医院和Novosibirsk市第一医院)开展合作, 进行临床试验。在《BMC Cancer》上发表的FAC/AC连续化疗3疗程联合Panagen的结果显示: Panagen将化疗结束3年内的乳腺癌复发率从45%显著降低至24%。Panagen对52%的患者有明显的效果。与安慰剂组相比, Panagen有效组患者的白细胞(P< 0.05)、中性粒细胞(P< 0.01)、单核细胞(P< 0.09)和淋巴细胞计数水平显著提高。与第一个化疗疗程结束后的水平相比较, Panagen有效组的患者在第二和第三个化疗疗程结束后, 细胞计数水平没有显著下降; 而安慰剂对照组患者在第三个化疗周期结束后, 细胞计数水平都呈显著下降的趋势。此外, Panagen将血红蛋白下降率从100%降低到63%。
在临床前期研究中发现Panagen可诱导树突状细胞成熟与活化, 然而在Panagen的Ⅱ 期临床研究中没有发现外周血中树突状细胞的扩增; 其原因是成熟树突状细胞通常快速通过外周血锚定在淋巴器官中, 而不以游离的形式存在于外周血中; 成熟树突状细胞在外周血中的峰值时间也难以监测。然而, Panagen的Ⅱ 期临床研究中发现58%FAC化疗组和16%AC化疗组患者外周血中CD8+穿孔素+细胞毒性T细胞显著增加; 该发现间接地证明了树突状细胞的活化和其有效的抗原呈递能力。研究推测, 经过有效的化疗以后, 被环磷酰胺和多柔比星杀死的肿瘤细胞可释放大量免疫原性的残留物, 可为继发性免疫反应提供丰富的肿瘤抗原。因此, Panagen介导的继发性抗肿瘤免疫反应具有高度个性化的特征。2016年, 该课题组在《BMC Cancer》报道Panagen联合FAC/AC化疗治疗Ⅱ ~Ⅳ 期乳腺癌的5年无疾病生存率为53%, 高于安慰剂组的40%; 将Ⅲ 期乳腺癌患者的5年无疾病生存率由25%提高到52%; 尤其是在Ⅲ B/C期乳腺癌患者中, Panagen将5年无疾病生存率由17%提高到50%。这些预后数据进一步证实了Panagen的抗肿瘤作用。
值得关注的是, 研究者试图通过对比Panagen组和安慰剂组的3年复发率和5年无疾病生存率来评估Panagen的抗肿瘤作用, 然而Ⅱ 期临床试验的入组病例数只有80例; 得到的3年复发率和5年无疾病生存率结果均是描述性结果, 没有进行统计学分析。例数太少是无法得到有统计学意义结果的原因; 此外, 该研究没有考虑到其他影响患者预后的多种因素, 也无法得到令人信赖的统计学分析结果。
相较于G-CSF短效的生白细胞药物, Panagen具有长效生白细胞的作用。因此, 在Ⅱ 期临床试验的整个化疗间期, 试验组患者都服用Panagen。然而, 该研究在升白细胞体系评价方面也存在临床试验设计的缺陷。通常临床上评价升白细胞药物的疗效一般是在化疗后第1~2周内的多天检测白细胞水平进行评价, 因为白细胞减少会在化疗后不久即可发生, 并在接下来的1~2周内处于持续下降的状态, 达到最低点后可以逐渐回归。如接受蒽环类治疗的患者, 白细胞的最低点一般出现在化疗后第8~14天。然而, Panagen的Ⅱ 期临床研究在第一次化疗结束后第21天、第二次和第三次化疗疗程结束后第14天和第21天检测白细胞的水平, 这个时候白细胞已开始逐步回升, 不能反映化疗药物对白细胞的抑制和Panagen的升白细胞效果。尽管在三个化疗疗程后, 相比安慰剂组Panagen能显著地升高单核细胞水平(P< 0.05), 一定程度上升高白细胞和淋巴细胞水平(P< 0.11); 但是, 由于缺乏化疗后1周以内的检测数据, 该研究的结果无法获得临床上肯定的疗效评价。
Panagen在乳腺癌化疗患者的Ⅱ 期临床试验, 由于数据不足, 升白细胞疗效不确切, 其结论还不足以改变临床常规指南。这个研究中, 研究者关注较多的是Panagen dsDNA诱导继发性免疫反应的机制和抗肿瘤作用。试验结果显示, Panagen组的3年和5年无疾病生存率高于安慰剂组, 但是研究者没有提供统计学分析结果。研究者对Panagen升白细胞作用的机制没有确切的描述; 由于缺乏阳性对照组(如G-CSF), 无法判断Panagen的升白细胞作用是否优于现有的治疗方式, 因此无法对临床有现实的指导意义。
The authors have declared that no competing interests exist.