作者简介:
 | 刘强,现任中山大学孙逸仙纪念医院普外科主任、乳腺肿瘤中心主任、乳腺外科主任、教授、研究员及博士研究生导师。 现任美国临床肿瘤学会ASCO会员、美国癌症研究协会AACR会员,并应邀担任多个国际 SCI 学术期刊的审稿人,中国国家自然科学基金委的评审专家,《中国普通外科杂志》编委,《中华乳腺病杂志》编委,中国抗癌协会肿瘤分子医学专业委员会常务委员,中国抗癌协会乳腺癌专业委员会委员。 刘强教授1996年中南大学湘雅医学院七年制临床医学专业毕业获外科学硕士学位, 2000-2004 年获新加坡全额奖学金资助于新加坡国立大学医学院外科攻读并获得博士学位。其后在新加坡国立大学肿瘤研究所及美国哈佛大学 Dana Farber 癌症中心任博士后, 2008 年晋升为哈佛大学Dana Farber 癌症中心及 Brigham and Women 医院肿瘤科讲师 (Instructor in Medicine) , 2011 年以中山大学 “ 百人计划 ” 人才引进回国。长期从事乳腺肿瘤外科临床及科研工作,先后以第一作者或通讯作者在国际著名肿瘤学术期刊《Cancer Cell》及《Nature Communications》等杂志上发表多篇SCI论文,参编多本英文肿瘤学术专著,并多次在国际肿瘤学术会议上做大会发言。 |
Nanda R, Chow LQ, Dees EC, et al. Pembrolizumab in patients with advanced triple-negative breast cancer: PhaseⅠ b KEYNOTE-012 study[J]. J Clin Oncol, 2016, 34(21): 2460-2467.
2c。
• 派姆单抗(Pembrolizumab)是一种高亲和力和高选择性的抗PD-1单克隆IgG4-k抗体, 派姆单抗已被证实在其他肿瘤抗PD-1治疗中具有较好的疗效。
• 约20%~30%三阴性乳腺癌(triple-negative breast cancer, TNBC)存在高PD-L1 mRNA表达, 基因表达谱分析表明免疫调节基因的高表达与TNBC的良好预后有关。
• 缺乏Pembrolizumab运用于晚期TNBC的临床研究数据。
评估PD-1抑制剂Pembrolizumab治疗晚期TNBC患者的安全性及抗肿瘤疗效。
• 研究条件: 美国、以色列、比利时的医学研究机构共同参与的国际临床注册研究: KEYNOTE-012(ClinicalTrials. gov NCT01848834)。
• 研究时间: 2014年1月至2015年3月。
• 研究方法: 多中心, Ⅰ b期, 非随机对照临床试验。
• 研究对象: 诊断明确的PD-L1阳性晚期TNBC患者。
• 评价指标: 不良事件(adverse event, AE)、肿瘤总缓解率(overall response rate, ORR)、完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)。
• 干预措施: 每2周10 mg/kg Pembrolizumab静脉给予晚期PD-L1阳性TNBC患者, 治疗方案和评估方案见图1。
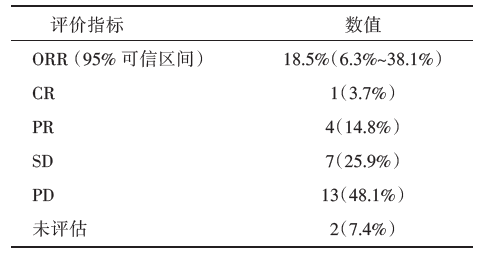
| 表1 KEYNOTE-012研究的主要疗效结果 |
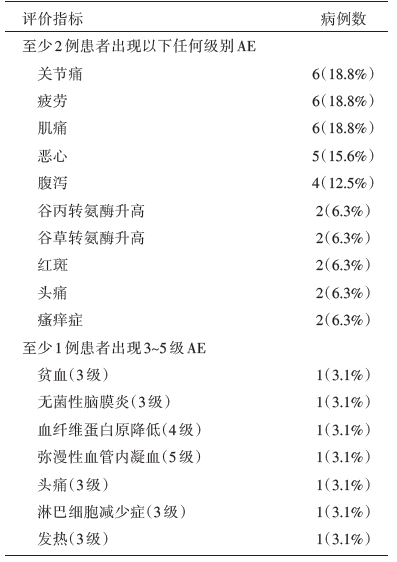
| 表2 治疗相关的AE |
TNBC是指雌激素受体、孕激素受体及表皮生长因子受体2(HER2)免疫组化表达为阴性的乳腺癌, 这类患者术后短期内复发风险较高, 而且由于治疗手段的局限(主要为化疗), 一旦复发转移预后差, 容易对化疗耐药, 晚期患者中位生存期仅为13~15个月。因此寻求新的治疗手段是提高TNBC疗效的关键。
PD-1是一个免疫检查点蛋白, 在多种免疫细胞包括T细胞、B细胞和DC细胞中均有表达, 有重要的调节免疫系统功能的作用, 可促进抗原特异性T细胞程序性细胞死亡, 同时减少具有抗炎作用的调节T细胞的凋亡。其配体(PD-L1/PD-L2), 在多种实体瘤如TNBC中表达增高[1]。研究表明, PD-1/PD-L1通路的激活会诱导细胞毒性T细胞的失能, 耗竭、凋亡以及减少细胞因子的产生, 抑制抗肿瘤反应[2], 导致肿瘤细胞逃避免疫系统的识别和杀伤[3]。而靶向PD-1/PD-L1通路的抗体可以阻断这一免疫逃逸。PD-1抗体Pembrolizumab因其在黑色素瘤等肿瘤临床试验中的突出疗效, 已经于2014年10月被FDA加速批准上市, 但在晚期TNBC中的疗效尚缺乏临床证据。
KEYNOTE-012研究队列中的TNBC研究是多中心的Ⅰ b期非随机对照研究。此研究一共入组32例PD-L1阳性(> 1%)复发或者转移TNBC患者, 旨在评估Pembrolizumab在晚期TNBC患者中治疗的安全性及抗肿瘤疗效。虽然用药剂量较高(每2周10 mg/kg静脉给药), 其治疗的安全性及耐受性被认为在可接受的范围内, 3~5级的不良反应率仅为15.6%, 但有1例发生了可能与治疗相关的严重的血小板减少和弥漫性血管内凝血。在可评估的27例患者中, ORR为18.5%, CR 1例, PR 4例。其中CR的患者之前已经针对转移性乳腺癌接受了包括蒽环、紫杉醇、铂类、卡培他滨和艾日布林在内的八线治疗。PR的4位患者也分别接受了1~6线的治疗, 说明免疫治疗在多线治疗后的患者也有一定疗效。
该项研究是首次评估Pembrolizumab治疗TNBC的安全性及疗效, 为之后的Ⅱ /Ⅲ 期临床研究奠定了基础, 也为乳腺癌的免疫治疗提供了依据。但是该研究也有不少不足之处。首先, 该研究是Ⅰ b期研究, 样本量小(仅32例), 中位随访时间仅为10个月。其次, 入组患者之前的治疗方式及次数差别较大, 可能影响免疫治疗的疗效, 尚缺乏进一步的信息, 如雄激素受体(AR)是否阳性、BRCA有无突变、肿瘤浸润淋巴细胞比例、肿瘤突变负荷和Ki67阳性比例等因素均未提及。最近的一些研究显示, PD-1阳性的肿瘤浸润淋巴细胞而不是PD-L1肿瘤细胞的比例更能作为肿瘤预后指标[4]。再者, 目前已知免疫治疗单药疗效有限, 与化疗或抗血管生成剂等其它治疗联用可能显著增强免疫治疗的疗效。因此, Pembrolizumab治疗乳腺癌的Ⅱ /Ⅲ 期临床研究可以通过扩大样本量, 选择更同质化的患者入组并设置亚组, 设计可能增效的联合治疗, 检测可能预测预后的分子标志等方式来优化试验设计。目前, Pembrolizumab及其他PD-1/PD-L1通路阻滞剂单药或者联合其他靶向药或者化疗等方式治疗乳腺癌已进入Ⅲ 期临床研究。
综上所述, 以本研究为首的诸多免疫治疗试验成为近年来研究的热点, 治疗晚期乳腺癌已取得不小进展, 但是在最佳使用人群和最佳使用方式等方面仍面临很多问题。治疗前后肿瘤抗原表达的改变、新抗原的产生、肿瘤局部免疫微环境的改变等都会影响最终的治疗效果。因此, 积极探索新的个体化有效治疗方式, 改善患者预后, 仍是将来努力的方向。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|